Электрохимическими называются процессы, связанные с взаимным превращением электрической и химической энергий. Преобразование энергии химической (окислительно-восстановительной) реакции в электрическую осуществляется в гальванических элементах. Если взять два металла с различными электродными потенциалами, соединить их проводом, опустить в растворы их солей, соединенных между собой электролитическим ключом, то получится гальванический элемент (рис. 6.1). Интенсивность реакции окисления-восстановления, протекающей в гальваническом элементе, характеризуется величиной разности потенциалов - электродвижущей силой гальванического элемента (ЭДС).
Электрод, на котором происходит процесс окисления, называется анодом, а электрод, на котором происходит процесс восстановления, называется катодом.
Электродный потенциал металла определяется процессом перехода ионов металла в раствор (окисление) и обратным процессом присоединения ионами металла электронов (восстановление), т.е. окислительно-восстановительным равновесием
Ме0 D Men+ + nē.
ЭДС гальванического элемента можно вычислить по уравнению Нернста:
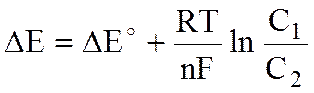 ,
,
где DЕ - ЭДС гальванического элемента; DЕº - стандартная ЭДС; R - универсальная газовая постоянная, равная 8,316 Дж/моль·К; Т – температура, К; n - число электронов, переносимых в окислительно-восстановительной реакции; F - постоянная (число Фарадея), равная 96500 кулонов; С1 и С2 - концентрации ионов соответствующих металлов в растворе. Стандартную ЭДС гальванического элемента можно подсчитать, если из стандартного электродного потенциала катода вычесть стандартный электродный потенциал анода: DЕº = Еºkat - Еºan.
Стандартным электродным потенциалом Е° называется потенциал растворения металла, погруженного в раствор собственного иона с концентрацией (или активностью), равной единице (г-ион/л). Измерение Е° производится по сравнению с нормальным водородным электродом, потенциал которого условно принят равным нулю (приложение 7).
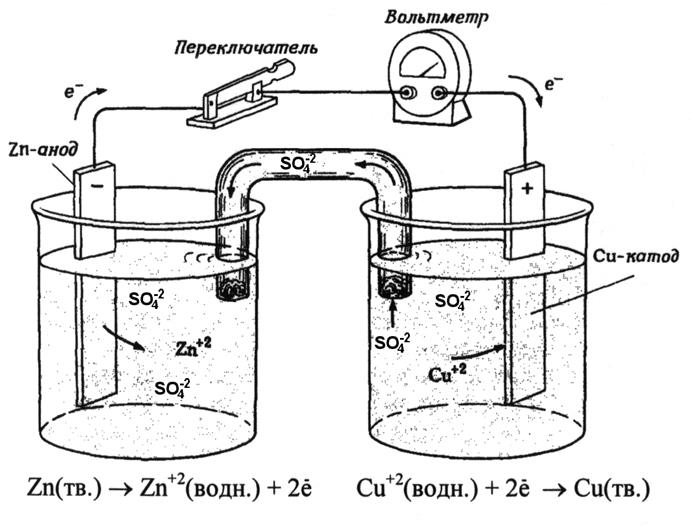
Рис. 6.1. Схема гальванического элемента Даниэля - Якоби
Располагая металлы в порядке возрастания их стандартных электродных потенциалов, получим электрохимический ряд стандартных электродных потенциалов металлов (приложение 8). В этот ряд всегда помещается водород, что позволяет видеть, какие металлы способны вытеснять водород из водных растворов кислот. Положение того или иного металла в ряду напряжения и характеризует его способность к окислительно-восстановительным взаимодействиям в водных растворах при стандартных условиях.
Величина ЭДС работающего гальванического элемента всегда меньше, чем рассчитанная по формуле Нернста, вследствие поляризации электродов, т.е. изменения их потенциалов при работе гальванического элемента. Наибольшее значение при работе гальванических элементов имеет катодная поляризация, возникающая за счет накопления избыточных электронов на катоде, и его потенциал становится более отрицательным. Разность между фактическим потенциалом катода и теоретическим электродным потенциалом называется перенапряжением на катоде. Величина перенапряжения зависит от материала катода, состояния его поверхности, температуры и плотности тока.
Точное измерение ЭДС гальванического элемента требует применения специальных приборов, обеспечивающих протекание через гальванический элемент ничтожно малого тока. Если допустить протекание значительного тока, напряжение гальванического элемента понижается, так как он обладает внутренним сопротивлением, и, кроме того, вокруг электродов происходит изменение концентрации ионов в растворе.
Экспериментально установлено, что ЭДС гальванического элемента не зависит от размера и формы твердых электродов, а зависит от концентрации ионов. Если концентрации реагентов повышаются относительно концентраций продуктов, это приводит к повышению степени самопроизвольности протекающей в гальваническом элементе реакции и возрастанию его ЭДС и наоборот. Во время работы гальванического элемента происходит расходование реагентов и образование продуктов. Связанное с этим уменьшение концентраций реагентов и возрастание концентраций продуктов вызывает постепенное уменьшение ЭДС элемента.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.