rG = DH - Т ·DS,
где DS– изменение энтропии, Т – абсолютная температура.
Энергия Гиббса является функцией состояния системы, определяющей величину той части энтальпии, которая еще не рассеялась и за счет которой система может совершать работу. Самопроизвольное возрастание энтропии S, сопровождающее приближение системы к равновесию, характеризуется переходом энтальпии H из концентрированной формы энергии Гиббса G в рассеянную Т·S. Таким образом, в самопроизвольных процессах энергия Гиббса убывает (rG < 0). При достижении равновесия она принимает минимальное значение (G = Gmin), а ее приращение обращается в ноль (rG = 0). Термодинамический анализ возможности протекания химической реакции, таким образом, состоит в определении величины и знака энергии Гиббса реакции rGреак. При rGреак< 0 самопроизвольное протекание реакции возможно, при rGреак= 0 реакция находится в состоянии равновесия, а при rGреак > 0 самопроизвольное протекание реакции запрещено.
2. Экспериментальная часть
одноосновной кислоты раствором основания
Работа производится в упрощенном калориметре, изображенном на рис. 3.1.
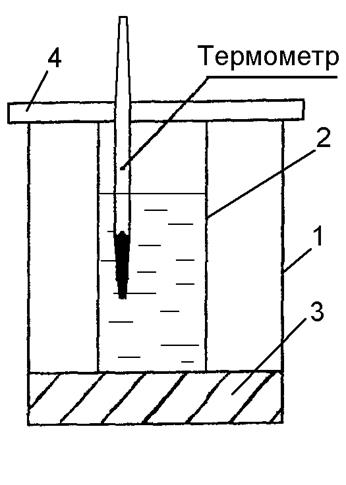
Рис. 3.1. Схема калориметра
(обозначения в тексте)
Калориметр состоит из наружного 1 и внутреннего 2 стаканов. Внутренний стакан ставится на асбестовую прокладку 3 в целях уменьшения теплоотдачи. Наружный стакан закрывается пластиковой крышкой 4, через которую во внутренний стакан вставлен термометр с ценой деления в 0,1°С.
Отмерьте цилиндром 25 мл 1 М раствора кислоты и вылейте во внутренний стакан калориметра. В другой цилиндр налейте 25 мл 1 М раствора основания.
Измерьте температуру раствора кислоты с точностью до 0,1°С. Температура основания такая же, так как оно хранится в одних условиях с кислотой. Не вынимая из раствора кислоты термометр, вылейте раствор основания в кислоту. Осторожно перемешайте раствор, наблюдая за изменением температуры раствора. Определите наибольшую его температуру как tконеч. Данные эксперимента запишите в таблицу 3.1.
Таблица 3.1
|
№ задания |
Исходные вещества |
Объем V, мл |
Температура t, °С |
||||
|
кислота |
основание |
кислота |
основание |
tнач. |
tконеч. |
Dt |
|
|
1 |
НСl |
КОН |
25 |
25 |
|||
|
2 |
HNO3 |
КОН |
25 |
25 |
|||
|
3 |
СН3СООН |
КОН |
25 |
25 |
|||
|
4 |
СН3СООН |
NH4OH |
25 |
25 |
|||
Теплота, выделенная при реакции нейтрализации, расходуется на нагревание раствора. Теплотой, расходуемой на нагревание калориметра, можно пренебречь.
Вычислите теплоту нейтрализации 25 мл 1 М раствора кислоты 25 мл 1 М раствором основания по формуле
Q = Ср · mS ·D t, (3.1)
где Ср – удельная теплоемкость раствора при постоянном давлении, mS - общая масса раствора в калориметре, Dt– изменение температуры в калориметре.
Удельную теплоемкость раствора при постоянном давлении Ср принимают равной теплоемкости воды, т.е. 4,184 Дж/г·град.
Общая масса раствора, равная сумме масс кислоты и основания, определяется как произведение плотности раствора r на его общий объем VS = Vкисл. + Vоснов., т.е.
mS= r ·VS.
Плотность r раствора принимается равной 1 г/см3.
Изменение температуры в калориметре из-за теплового эффекта реакции нейтрализации определяется простым вычитанием с учетом полученного знака.
Dt = tнач. - tконеч.
Учитывая, что энтальпия реакции нейтрализации DHнейтр.относиться к молю вещества и выражается в кДж/моль, вычислите
DHнейтр.=
![]() , (3.2)
, (3.2)
где n– число молей реагентов. В нашем случае n = 0,025, так как в 25 мл 1 М раствора кислоты задержится 0,025 моль кислоты.
Зная, что теоретическое значение энтальпии реакции нейтрализации сильной одноосновной кислоты сильным основанием в разбавленном растворе DH тнейтр = -57,27 кДж/моль, рассчитайте погрешность эксперимента h для заданий 1 и 2.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.