Решение. В данном гальваническом элементе протекает реакция Cd+2 + Zn = Zn+2 + Cd. Между константой равновесия реакции, протекающей в гальваническом элементе, и ЭДС гальванического элемента существует зависимость E = (0.059/n)×lgK;
E = (0.059/2)×lg2.022×105 = 0.157 В.
![]() ;
;
![]() = E +
= E +![]() = 0.157 - 0.789 = -0.632 В.
= 0.157 - 0.789 = -0.632 В.
Пример 4. Определите ЭДС гальванической цепи:
Fe /0.1 м. FeSO4 // 0.01 н. NaOH /H2, Pt. Cтепени электролитической диссоциации FeSO4 и NaOH соответственно равны 60 и 100%.
Решение. Для определения ЭДС этого гальванического элемента необходимо определить концентрацию ионов Fe+2 в 0.1 м FeSO4 и концентрацию ионов Н+ в 0.01 н. NaOH:
Сиона = Сэлектр.×n×a,
![]() = 0.1×1×0.6
= 0.06 моль/л.
= 0.1×1×0.6
= 0.06 моль/л.
Концентрация ионов OH- и Н+ в 0.01 н. NaOH:
![]() =
0.01×1×1 = 0.01 моль/л.,
=
0.01×1×1 = 0.01 моль/л., ![]() = 10-14/10-2
= 10-12 моль/л.
= 10-14/10-2
= 10-12 моль/л.
Электродный потенциал железа:
![]() =
-0.44 + (0.059/2)×lg
6×10-2 = -0.476
В.
=
-0.44 + (0.059/2)×lg
6×10-2 = -0.476
В.
Электродный потенциал водородного электрода:
![]() =
0 + 0.059×lg 10-12 = -0.708
В.
=
0 + 0.059×lg 10-12 = -0.708
В.
В соответствии с величинами электродных потенциалов работает следующая гальваническая цепь:
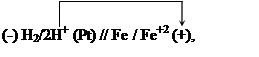 |
Ее электродвижущая сила равна:
![]() = -0.476 – (-0.708) = 0.232 В.
= -0.476 – (-0.708) = 0.232 В.
Пример 5. Определение ЭДС гальванической цепи с учетом активности ионов. Вычислите ЭДС газоводородной цепи:
Pt, H2 /0.008 н. NaOH // 0.006 н. HCl/ H2, Pt,
если коэффициенты активности ионов равны: ![]() = 0.944;
= 0.944; ![]() = 0.916. Степень
диссоциации приведенных электролитов принять равной 100%.
= 0.916. Степень
диссоциации приведенных электролитов принять равной 100%.
Решение. Сначала определяем
концентрации ионов Н+ и ОН- в растворах НС1 и NaOH: ![]() = 0.006 моль/л;
= 0.006 моль/л; ![]() =
0.008 моль/л. Активности ионов равны: a = f×C, следовательно,
=
0.008 моль/л. Активности ионов равны: a = f×C, следовательно, ![]() =0.008×0.916 = 7.33×10-3
моль/л..,
=0.008×0.916 = 7.33×10-3
моль/л.., ![]() = 0.006×0.944 = 5.66×10-3
моль/л.
= 0.006×0.944 = 5.66×10-3
моль/л.
По активности ионов OH- определяем активность ионов Н+ в растворе NaOH:
![]() =
10-14/ 7.33×10-3 = 1.36×10-12 моль/л.
=
10-14/ 7.33×10-3 = 1.36×10-12 моль/л.
По уравнению
Нернста вычисляем потенциал водородного электрода в растворе NaOH: ![]() = 0.059×lg1.36×10-12
= -0.700 В,
= 0.059×lg1.36×10-12
= -0.700 В,
и в растворе НСl: ![]() = 0.059×lg5.66×10-3
= -0.133 В.
= 0.059×lg5.66×10-3
= -0.133 В.
Анодом является электрод в растворе NaOH, а катодом – в растворе НСl.
Гальваническая цепь работает по следующей схеме:
(-) Pt, H2/ 0.008 н. NaOH // 0.006 н. HCl/ H2, Pt (+),
Электродвижущая сила, возникающая при работе этой
гальванической цепи, равна:
E = -0.133 – (-0.700) = 0.567 В.
|
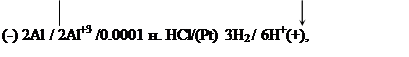 |
если в процессе работы элемента концентрация ионов Al+3 меняется от 0.003 до 0.1, а перенапряжение h водорода на платине равно 0.09 В. Чему равна концентрационная поляризация анода?
Решение. Сначала нужно определить начальные электродные потенциалы анода и катода гальванического элемента:
![]() = -1.66 +(0.059/3)×lg3×10-3 = -1.71 В.
= -1.66 +(0.059/3)×lg3×10-3 = -1.71 В.
![]() = 0.059×lg10-4 = -0.236 В.
= 0.059×lg10-4 = -0.236 В.
Начальная ЭДС гальванического элемента равна:
![]() = -0.236 – (-1.71) = 1.48 В.
= -0.236 – (-1.71) = 1.48 В.
Концентрационная поляризация определяется следующим образом:
Eполяр = (0.059/n)×lg (C2/C1),
где C1 - меньшая концентрация иона, моль/л; C2 - большая концентрация иона, моль/л.
Для алюминиевого электрода концентрационная поляризация равна:
Eполяр = (0.059/3)×lg (0.1/0.003) = 0.029 В.
С учетом концентрационной поляризации потенциал алюминиевого электрода равен.
![]() = -1.71 + 0.029 = -1.68 В.
= -1.71 + 0.029 = -1.68 В.
Потенциал катода с учетом величины перенапряжения выделения
водорода на платине равен: ![]() = -0.23 – 0.09 = -0.32
В.
= -0.23 – 0.09 = -0.32
В.
Конечная ЭДС гальванического элемента равна: E2 = -0.32 – (-1.68) = 1.36 В, а ЭДС гальванического элемента в процессе работы уменьшилась на разность:
1.48 - 1.36 = 0.12 В.
Перенапряжением h называют повышение потенциала разрядки ионов по cравнению с величиной стандартного потенциала в равновесных условиях.
Пример 7. Рассмотрите коррозию изделия
из алюминиевой бронзы:
а) в дистиллированной воде; б) в сильнощелочной аэрированной среде (раствор
NaOH). Приведите уравнения электродных процессов. Какие вещества являются
продуктами коррозии?
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.