Пассивное состояние металлов имеет большое практическое значение, т.к. коррозионная стойкость многих технических металлов и сплавов часто бывает обусловлена их пассивностью. Коррозионную стойкость металлов можно увеличить, легируя их другими более легко пассивирующимися (или облегчающими наступление пассивного состояния) металлами или введением в электролит пассиваторов.
Защита ингибиторами.
Защиту ингибиторами применяют в системах с постоянным или мало обновляемым объемом коррозионной среды (в цистернах, котлах, химических аппаратах и т.д.).
Ингибиторы – химические соединения или композиции на их основе, введение которых в небольших количествах (до 1%) в коррозионную среду резко снижает скорость коррозии. По составу различают ингибиторы органические (для борьбы с атмосферной коррозией) и неорганические (для защиты металлов в жидких средах). По механизму действия на процесс электрохимической коррозии, они подразделяются на катодные, анодные и экранирующие. По условиям применения – на ингибиторы для растворов и летучие ингибиторы. Практическое использование их определяется эффективностью действия, токсичностью, экологичностью.
Механизм действия большинства ингибиторов заключается в адсорбции их на корродирующей поверхности и последующем торможении анодных (анодные ингибиторы) и катодных (катодные ингибиторы) процессов электрохимической коррозии, а также в образовании защитных и пассивирующих плёнок (экранирующие ингибиторы).
Зависимость скорости коррозии от содержания NaNO2 в водно-бензиновой коррозионной среде.
|
Содержание NaNO2, % |
0,00 |
0,02 |
0,04 |
0,06 |
0,10 |
|
Скорость коррозии, мм/год |
0,11 |
0,08 |
0,02 |
0,00 |
0,00 |
Выполнение работы
1. Приборы, посуда и реактивы:
Опыт 1: 4 стальных образца, 5 химических стаканов, растворы HNO3 (20, 30, 40, 50 и 60%),
Опыт 2: Установка для определения эффективности действия ингибитора, пробирка, 15% HCl, образец стали, 1% раствор уротропина.
2. Схема установки
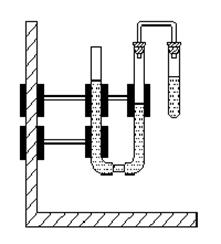
Рис. 2.1. Установка для определения эффективности ингибитора.
3. Последовательность выполнения работы
3.1. Пассивирование стали в азотной кислоте.
3.1.1. Определение пассивирующей концентрации HNO3.
Один стальной образец на стеклянном крючке поочередно погружают в стаканы с растворами HNO3, начиная с 20% концентрации и кончая 60%, с выдержкой при концентрации 20, 30, 40 и 50% по 10 сек. После этого образец оставляют в 60% растворе HNO3. При каждом погружении образца в очередной раствор HNO3, наблюдают за скоростью растворения в нём стали, и отмечают концентрацию кислоты, при которой наступает пассивность стали – прекращение выделения пузырьков газа и окрашенных продуктов реакции на поверхности образца. Результаты наблюдений (активное растворение, наступление пассивности) записывают в таблице 2.1. (опыты 1-5).
3.1.2. Наблюдение устойчивости пассивного состояния стали.
Извлекают образец стали из 60% HNO3 и погружают на 10 сек в 50%-ную, затем в 40, 30 и в 20%-ную HNO3, образец оставляют в последнем (20% р-р) стакане. Наблюдают за поведением образца (растворяется или не растворяется) в каждом растворе и записывают наблюдения в таблицу 2.1.(опыты 6-9).
3.1.3. Депассивация стали.
Стальной образец, не вынимая из 20% HNO3, приводят в соприкосновение на несколько секунд с зачищенным ранее вторым (незапассивированным) образцом стали, опуская последний на стеклянном крючке в раствор. Удалив затем из раствора незапассивированный образец, наблюдают за поведением основного образца (растворяется или не растворяется) в 20% HNO3. Результаты наблюдений записывают в таблицу 2.1.(опыт 10).
Таблица 2.1. Экспериментальные данные и наблюдения.
|
№ опыта |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
После контакта с незапассивированным образцом |
|
Конц. HNO3 , % |
20 |
30 |
40 |
50 |
60 |
50 |
40 |
30 |
20 |
20 |
|
Наблюдения |
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.