В случае анодного контроля скорость коррозии снижается при возрастании концентрации ионов металла вблизи поверхности. При этом может происходить образование трудно растворимых солей, которые, экранируя поверхность металла, вызывают диффузионные затруднения в протекании анодной реакции.
Торможение анодной реакции возможно в результате пассивации металла при контакте с сильным окислителем. Пассивное состояние металла характеризуется признаками:
· смещением потенциала металла в положительную сторону;
· скорость коррозии значительно снижена и постоянна во времени.
Возникновение пассивного состояния зависит от природы металла, его свойств, вида агрессивной среды (концентрации окислителя, содержания растворённого кислорода), температуры, скорости перемешивания электролита. Нарушение пассивного состояния называется перепассивацией.
Бороться с перепассивацией можно, смещая потенциал металла в отрицательную сторону, уменьшая концентрацию окислителя, добавляя восстановитель, или путём катодной поляризации металла внешним источником тока.
Повышение температуры облегчает диффузию веществ, участвующих в электродных процессах. Температура влияет на концентрацию в агрессивных средах веществ, принимающих участие в электродных процессах. Коррозия в нейтральных средах с кислородной деполяризацией снижается с ростом температуры из-за деаэрации растворённого кислорода. Изменение температуры может снижать защитные свойства плёнок из вторичных продуктов (оксидов, гидроксидов, трудно растворимых солей), а также менять тип полярности металлических защитных покрытий: цинковое покрытие на углеродистой стали ведёт себя как анодное, а в горячей воде – как катодное. Повышение температуры может привести как к интенсификации, так и к замедлению процесса коррозии.
По влиянию pH среды металлы подразделяют на группы:
1. Металлы с высокой коррозионной стойкостью в кислотных, щелочных и нейтральных растворах (такие как Au, Pt, Ag). Их скорость коррозии не зависит от pH среды (Рис. 1 а).
![]()
![]()
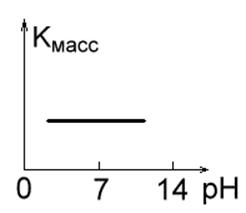
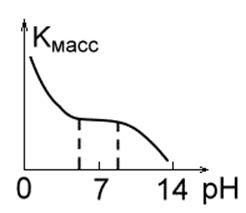
Рис. 1 а. Рис. 1 б.
2. Металлы, малостойкие в кислотных средах, такие как Fe, Mg, Cu, Mn. При небольших значениях pH скорость их разрушения велика, легко выделяется водород, и образуются растворимые продукты коррозии. В интервале pH = 4.0¸8.5 скорость коррозии этих металлов постоянная. При pH ³ 10 образуются нерастворимые гидроксиды, и скорость коррозии резко падает (рис.1 б.).
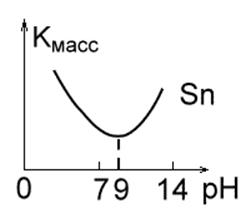
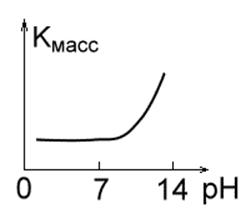
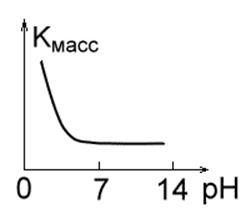
Рис. 1 в. Рис. 1 г.Рис. 1 д.
3. Металлы, устойчивые в нейтральных средах, но разрушающиеся в щелочных и кислотных растворах из-за их амфотерности (Рис. 1 в). Это Zn, Al, Sn, Pb. Для них характерно определённое значение pH раствора, при котором скорость коррозии минимальна: Al - 7.0; Pb - 8.0; Sn - 9.0; Zn - 10.0; Fe - 14.0.
4. Металлы, устойчивые в кислотных, но нестойкие в щелочных средах: Mo, Ta, W. (Рис. 1 г.).
5. Металлы, малостойкие в кислотных средах, но устойчивые в щелочных: Ni, Cd. (Рис. 1 д).
Влияние давления носит сложный характер. Из-за возрастания скорости диффузии кислорода вначале коррозия увеличивается, затем скорость коррозии уменьшается, так как на поверхности металла образуется защитная плёнка. Скорость коррозии резко возрастает вследствие механического удаления защитной плёнки движущимся потоком электролита. Скорость движения электролита более сильно влияет на коррозию с кислородной деполяризацией, чем с водородной.
С возрастанием концентрации раствора скорость коррозии сначала увеличивается, а затем уменьшается. Увеличение коррозии объясняется увеличением электрической проводимости раствора (усиление анодной реакции), а уменьшение коррозии связано с понижением растворимости кислорода.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.