Коррозионная среда, способствующая коррозионному растрескиванию под напряжением, специфична для определенного металла, например, аммиак - для медных сплавов, растворы хлоридов - для аустенитной хромоникелевой стали, растворы нитратов - для углеродистых сталей. Большое влияние также оказывает присутствующий в среде кислород, значение электродного потенциала и pН среды. Коррозия растрескивания характеризуется хрупкими изломами и трещинами двух типов: транскристаллитными, проходящими через кристаллиты и межкристаллитными, то есть, локализованными по границам кристаллитов.
Химическая и электрохимическая коррозия.
Такой тип классификации связан с различным механизмом взаимодействия металла с окружающей средой. Но в обоих случаях практически всегда коррозия металла происходит на границе раздела фаз металл - коррозионная среда. По виду агрессивной среды различают газовую коррозию, атмосферную коррозию, почвенную коррозию, возникающую в грунтах под действием блуждающих электрических токов, коррозию в расплавах и растворах электролитов, коррозию под действием ионизирующих излучений, коррозию в сыпучих средах.
Причина коррозии – термодинамическая нестабильность металлов и сплавов. Процесс окисления большинства металлов протекает с уменьшением изобарно-изотермического потенциала G (энергии Гиббса). Для возможности протекания процесса коррозии должно соблюдаться условие DG < 0. Чем меньше значение DG, тем вероятнее возможность протекания коррозионного процесса. Изменение энергии Гиббса связано с величиной константы равновесия: DG = -RTlnK. Чем больше равновесие смещено в сторону образования продуктов коррозии, тем меньше величина DG.
Так как коррозия, это процесс, связанный с переносом электрического заряда, энергия Гиббса и ее изменение DG можно выразить через разность электродных потенциалов:
DG = -nFE,
где F – число Фарадея, Е = jК - jА - разность равновесных потенциалов катодных и анодных участков.
В основе процессов химической и электрохимической коррозии лежит гетерогенный окислительно-восстановительный процесс. Он состоит из последовательно протекающих реакций:
· диффузия частиц к поверхности металла;
· адсорбция частиц на поверхности металла;
· поверхностная химическая реакция;
· десорбция продуктов реакции с поверхности;
· перенос продуктов реакции в объем коррозионной среды.
Электрохимическая коррозия протекает при наличии в электрохимической системе окислителя, равновесный потенциал которого положительнее равновесного потенциала металлов. Окислителями могут служить ионы водорода или молекулярный кислород. В зависимости от значений электродных потенциалов металла и окислителя, и от pН среды на катоде может выделяться водород (водородная деполяризация) или поглощаться кислород (кислородная деполяризация).
Если потенциал металла более отрицателен, чем потенциал водорода, то может протекать коррозия с водородной деполяризацией:
Н3О+ + е =1/2Н2 + Н2О
Если потенциал металла положительнее потенциала окислителя, протекает коррозия с кислородной деполяризацией:
О2 + 2Н2О + 4е = 4ОН-
Электрохимическая система содержит три элемента : анод, катод, электролит. При коррозии в такой системе одновременно протекает две реакции, реализующиеся на участках поверхности с разными потенциалами:
анодная - окисление металла: Ме ®Ме+n + ne;
катодная - восстановление окислителя: Ох + ne®Red.
Электроны от восстановителя (анода) переходят к окислителю.
Равновесный потенциал φ электрохимической коррозии рассчитывают по уравнению Нернста. Для анодной реакции:
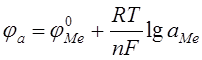
Равновесный потенциал катодной реакции для коррозии с водородной деполяризацией рассчитывают по уравнению:
![]()
Для коррозии с кислородной деполяризацией:
![]()
В реальных условиях во взаимодействии металла и электролита участвуют не только катионы данного металла, но и другие ионы или молекулы. Установившиеся при этом электродные потенциалы называются неравновесными или необратимыми. На значение неравновесного потенциала влияют температура, перемешивание раствора, его концентрация, природа и состояние поверхности металла.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.