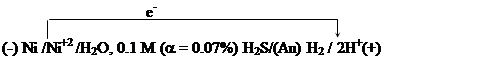 |
![]() ЭДС
этого гальванического элемента равна 0.285 В. Определите, как изменится ЭДС
гальванического элемента при его работе, если концентрация ионов Ni+2
возрастет до 0.25 моль/л, а перенапряжение выделения водорода на золоте
равно 0.15 В.
ЭДС
этого гальванического элемента равна 0.285 В. Определите, как изменится ЭДС
гальванического элемента при его работе, если концентрация ионов Ni+2
возрастет до 0.25 моль/л, а перенапряжение выделения водорода на золоте
равно 0.15 В.
21. Железо покрыто никелем. Какой из металлов будет корродировать в случае разрушения поверхности покрытия? Коррозия происходит в кислой среде. Составьте схему гальванического элемента, образующегося при этом.
22. Олово спаяно с серебром. Какой из металлов будет
окисляться при коррозии, если эта пара металлов попадет в щелочную среду? Ответ
дайте на основании вычисления ЭДС и ![]() образующегося
гальванического элемента.
образующегося
гальванического элемента.
23. Железо покрыто хромом. Какой из металлов будет корродировать в случае нарушения поверхностного слоя покрытия в атмосфере промышленного района (влажный воздух содержит CO2, H2S, SO2 и др.)? Составьте схему процессов, происходящих на электродах образующегося гальванического элемента.
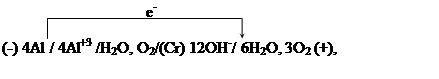 24. При работе
гальванического элемента
24. При работе
гальванического элемента
образовавшегося при коррозии алюминия, который находится в контакте с хромом, за 1 мин 20 с. его работы на хромовом катоде восстановилось 0.034 л кислорода. Определите, на сколько уменьшилась при этом масса алюминиевого электрода и чему равна сила тока, протекшего во внешней цепи гальванического элемента.
25. Алюминий склепан с медью. Какой из металлов будет
подвергаться коррозии, если эти металлы попадут в кислотную среду? Составьте схему
гальванического элемента, образующегося при этом? Подсчитайте ЭДС и ![]() этого элемента для стандартных условий.
этого элемента для стандартных условий.
26.Исходя из величины ![]() ,
определите, какие из приведенных ниже металлов будут корродировать во влажном
воздухе по уравнению
,
определите, какие из приведенных ниже металлов будут корродировать во влажном
воздухе по уравнению
Me + H2O + O2 ® Me(OH)2 (Me – Mg, Cu, Au)
27. Какие металлы: Fe, Ag, Ca - будут разрушаться в
атмосфере влажного воздуха, насыщенного диоксидом углерода? Ответ дайте на
основании вычисления ![]() соответствующих процессов.
соответствующих процессов.
Пример 1. Вычисление электродных потенциалов металлов. Вычислите электродный потенциал цинка, опущенного в раствор его соли с концентрацией ионов Zn+2 = 0.001 моль/л.
Решение. Вычисление электродного потенциала j производят по уравнению Нернста:
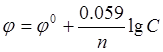
где j0-
стандартный электродный потенциал; n - число
электронов, участвующих в обратимо протекающем окислительно-восстановительном
процессе; C - концентрация катионов металла в
растворе, моль/л. Стандартный электродный потенциал цинка ![]() равен - 0,76 В. Отсюда
равен - 0,76 В. Отсюда ![]() = -0.76 + (0.059/2)×lg10-3 =
-0.76 - 0.0295×3 = -0.85 В.
= -0.76 + (0.059/2)×lg10-3 =
-0.76 - 0.0295×3 = -0.85 В.
Пример 2. Определение возможности протекания
реакции в гальваническом элементе. Исходя из величин стандартных электродных
потенциала и значения ![]() укажите, можно ли в
гальваническом элементе осуществить следующую реакцию:
укажите, можно ли в
гальваническом элементе осуществить следующую реакцию:
Fe + Cd+2 ® Fe+2 + Cd
Решение. Составим гальванический элемент, отвечающий этой реакции.
На аноде происходит окисление атомов железа: Fe – 2e = Fe+2,
на катоде - восстановление ионов кадмия: Cd+2 + 2e = Cd.
В гальваническом элементе отрицательным будет железный электрод, а положительным-кадмиевый. Схема гальванического элемента:
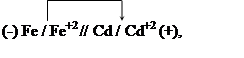 |
Пользуясь таблицей стандартных электродных потенциалов, определяем ЭДС этого гальванического элемента:
E = ![]() = -0.40 – (-0.44) = 0.04 В
= -0.40 – (-0.44) = 0.04 В
Изменение величины энергии Гиббса DG![]() с величиной ЭДС
элемента связано соотношением: DG
с величиной ЭДС
элемента связано соотношением: DG![]() = -nFE,
= -nFE,
где n - число электронов, принимающих участие в реакции, F - постоянная Фарадея (96500 Кл/моль); E - ЭДС гальванического элемента.
Следовательно, DG![]() = -2×96500×0.04 = -7720 Дж.
= -2×96500×0.04 = -7720 Дж.
Так как DG![]() < 0, поэтому данную реакцию
можно осуществить в гальваническом элементе. Реакция в выбранном направлении
протекает самопроизвольно.
< 0, поэтому данную реакцию
можно осуществить в гальваническом элементе. Реакция в выбранном направлении
протекает самопроизвольно.
Пример 3. Вычисление потенциала электрода по величине константы равновесия реакции. Константа равновесия реакции, протекающей в гальваническом элементе
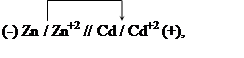 |
равна 2.022×105.
Определите электродный потенциал кадмия, если электродный потенциал цинка ![]() равен -0,789В.
равен -0,789В.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.