З. Оцените по фактору Пиллинга-Бедвордса защитные
свойства оксидных пленок из Al2O3 и CaO, если ![]() = 1.55 г/см3,
= 1.55 г/см3, ![]() = 3.40 г/см3,
= 3.40 г/см3, ![]() = 4.00 г/см3,
= 4.00 г/см3, ![]() = 2.73 г/см3.
= 2.73 г/см3.
4. В результате 20-летних испытаний образцов никеля
оказалось, что средняя скорость их атмосферной коррозии составила 0.037 мм/год
для городской промышленной атмосферы и 0.0020 мм/год для сельской атмосферы.
Рассчитайте скорость коррозии в г/(м2×сут), ![]() = 8.91 г/см3.
= 8.91 г/см3.
5. Исследовали газовую коррозию двух образцов меди при 70 и 700°C. Во сколько раз возрастет толщина оксидной пленки на них, если время испытаний увеличить с 8 до 64 ч?
6. Будет ли медь корродировать в деаэрированном
водном растворе CuSO4 с образованием ионов
Сu+2 и Н2, если pH = 5.3, ![]() = 10-2моль/л,
а
= 10-2моль/л,
а ![]() =1.013×105
Па? Ответ подтвердите расчетами. Какой будет при этом потенциал меди?
=1.013×105
Па? Ответ подтвердите расчетами. Какой будет при этом потенциал меди?
7. Рассчитайте скорость коррозии стального трубопровода в г/(м2×сут), если вода, поступающая в него со скоростью 50 л/мин, содержит 6.2 мл O2/л при 25°С и 0.1 МПа. а выходящая содержит 0.2 мл O2/л. Коррозия протекает на нагретом участке площадью 100 м2 с образованием Fe2O3.
8. Возможна ли коррозия железа с выделением водорода
в растворе с рН = 3, в котором ![]() = 10-3
моль/л? Приведите уравнения электродных процессов.
= 10-3
моль/л? Приведите уравнения электродных процессов.
9. Назовите металлы, которые корродируют с водородной деполяризацией в растворах с рН = 3, 7 и 9.
10. Какие процессы будут протекать при погружении цинковой пластинки в раствор CuCl2? Рассчитайте соотношение активностей ионов Zn+2 и Cu+2, при котором в системе установится равновесие.
11. Рассмотрите коррозию изделия из латуни (сплав Cu-Zn) в морской воде. Приведите уравнения электродных процессов и схему коррозионного микрогальванического элемента. Какие вещества при этом являются продуктами коррозии?
12. Определите, возможна ли коррозия меди во влажном
воздухе, насыщенном углекислым газом, по уравнению 2Cu(т)
+ O2(г) + H2O(ж) + CO2(г) =
(CuOH)2CO3(г) ?
Ответ подтвердите расчетом ![]() и ЭДС (E0) коррозионного микрогальванического элемента.
и ЭДС (E0) коррозионного микрогальванического элемента. ![]() (H2O) = 237.23 кДж/моль,
(H2O) = 237.23 кДж/моль, ![]() (CO2) = -394.37 кДж/моль,
(CO2) = -394.37 кДж/моль, ![]() ((CuOH)2CO3) = -901.00 кДж/моль. Приведите уравнения электродных
процессов.
((CuOH)2CO3) = -901.00 кДж/моль. Приведите уравнения электродных
процессов.
13. Серебро корродирует в растворе CuCl2,
с образованием твердого AgCl. Рассчитайте ЭДС коррозионного гальванического элемента,
если ![]() = 0.05,
= 0.05, ![]() = 0.1
моль/л. Приведите уравнения электродных процессов.
= 0.1
моль/л. Приведите уравнения электродных процессов. ![]() = 0.338
В,
= 0.338
В, ![]() = 0.222 В.
= 0.222 В.
14. Будет ли никель корродировать в деаэрированной
воде с pH = 8 с образованием водорода и гидроксида никеля, ПP которого при 25 °С составляет 1.6×10-14 (моль/л)3? Рассчитайте ЭДС
коррозионного микрогальванического элемента, если ![]() =
-0.234 В.
=
-0.234 В.
15. Гальванический элемент
 |
образовавшийся при коррозии хрома, спаянного со свинцом, дает ток силой 6А. Сколько граммов хрома окислится и сколько литров водорода выделится за 55 с работы этого элемента?
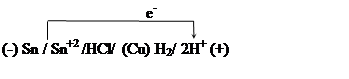 16. Медь покрыта оловом.
При нарушении оловянного покрытия работает гальванический элемент
16. Медь покрыта оловом.
При нарушении оловянного покрытия работает гальванический элемент
и дает ток силой 7.5 А. Сколько граммов олова растворится и сколько литров водорода выделится на медном катоде за 25 мин?
 17. При работе
гальванопары
17. При работе
гальванопары
за 1.5 мин образовалось 0.125 г Fe(OH)2. Вычислите объем кислорода, израсходованный на получение Fe(OH)2. Сколько электричества протекло по внешней цепи гальванического элемента за это время?
18. При нарушении поверхностного слоя цинкового покрытия на железе идет процесс коррозии вследствие работы гальванопары
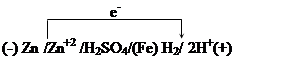 |
За 48 с работы этой гальванопары через внешнюю цепь протекло 550 Кл электричества. Сколько граммов Zn растворилось при этом и сколько литров водорода выделилось на железном катоде?
 19. При коррозии железа,
покрытого кадмием, в кислой среде работает гальванический элемент
19. При коррозии железа,
покрытого кадмием, в кислой среде работает гальванический элемент
Определите, как изменится ЭДС гальванического элемента из-за концентрационной поляризации железного анода и перенапряжения водорода (h = 0.8 В), если концентрация иона Fe+2 возросла до 0.15 моль/л.
20. Никель находится в контакте с золотом во влажном воздухе, насыщенном сероводородом. Коррозия никеля происходит вследствие работы гальванопары
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.