Tuesday, November 06, 2007
ГЛАВА 2.
ОСНОВНЫЕ ПОЛОЖЕНИЯ
ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ
»Очевидно, что изучать что-либо возможно лишь тогда, когда нечто уже признается за исходное несомненное, готовое в сознании. Таковым должно признать, напр., число, время, пространство, вещество, форму, движение, массу»
Д.И. Менделеев [14]
Термодинамика – метод физики, который используют в химии для изучения взаимосвязей между изменениями свойств веществ, участвующих в химических процессах и энергетическими характеристиками этих процессов
Основные задачи химической термодинамики состоят в оценках:
· характера перехода энергии от одних тел (веществ) к другим;
· энергетических эффектов в различных физических и химических процессах;
· возможности, направления и пределов протекания процесса.
Следует отметить, что механизм процесса, т.е. конкретную последовательность промежуточных стадий и скорость процесса термодинамика не рассматривает. Этими вопросами занимается химическая кинетика (см. раздел 2 настоящего пособия). Однако с помощью термодинамических методов можно оценить вероятность протекания процесса по механизму, предложенному на основе анализа кинетических закономерностей.
2.1 ОСНОВНЫЕ ОПРЕДЕЛЕНИЯ
Энергия
– мера способности тела совершать работу. Существуют различные классификации
видов энергии[1].
В прикладной физике п![]() ользуются классификацией,
которая включает:
ользуются классификацией,
которая включает:
· механическую энергию;
· потенциальную энергию тяжести;
· внутреннюю энергию нагретых тел;
· акустическую энергию;
· лучистую энергию, в том числе: энергию света, энергию теплового излучения, фотохимическую энергию, энергию рентгеновских лучей, энергию космических лучей;
· электрическую энергию, которая в свою очередь включает энергию зарядов и электрического тока;
· магнитную энергию.
В термодинамике различают внешнюю и внутреннюю энергию тел. Под внешней энергией понимают энергию движения тела как целого, а также энергию положения тела в поле сил (с учетом того, что термодинамическое состояние тела при его перемещении не меняется). Это так называемые кинетическая и потенциальная энергии тел.
Внутренняя энергия (U) – сумма всех видов энергии микрочастиц (атомов, молекул, электронов и др.), составляющих тело, часть полной энергии системы, не учитывающая ее кинетическую и потенциальную энергии.
Абсолютную величину внутренней энергии определить невозможно. Поэтому обычно пользуются величиной изменения внутренней энергии DU = U2 - U1 (где U2 и U1 -значения внутренней энергии тела в конечном и начальном состояниях соответственно). Поскольку U2 может быть больше или меньше, чем U1 величина DUоказывается положительной или отрицательной.
Если рассматривают бесконечно малое изменение внутренней энергии, то его записывают в обозначениях dU. Следует отметить, что величина dU имеет те же свойства, что и DU . Она не зависит от пути изменения состояния системы и на языке математики представляет собой полный дифференциал.
Термодинамическая система [2]– тело или совокупность тел, которые можно мысленно выделить из окружающей среды и которые могут взаимодействовать между собой, обмениваясь энергией и веществом.
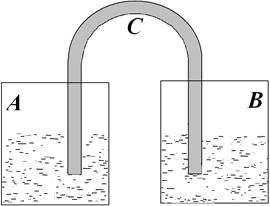
Рис. 2.1. Гальванический элемент А и В электроды; С – электролитический ключ
Граница системы может быть как материальной (например, стенка колбы или химического реактора), так и воображаемой, проведенной в пространстве мысленно. Она может быть также неподвижной или движущейся, проницаемой или непроницамой для вещества и энергии. Что принять за систему определяет исследователь. Например на рис. 2.1 схематично представлена установка (гальванический элемент) состоящий из двух электродов[1] А и В, соединенных между собой электролитическим ключем С. Подробнее устройство гальванического элемента описано в разделе 7.
Любой из узлов этой установки, как и сама установка, могут быть приняты за термодинамическую систему. Это означает, что термодинамическую систему можно представить состоящей из суммы простых систем. Отсюда вытекает аддитивность свойств термодинамической системы.
Следует отметить, что в общем случае аддитивность имеет место, если в системе отсутствуют какие - либо химические взаимодействия между молекулами. Поэтому, в частности, для оценки внутренняя энергия идеалного газа можно использовать правило аддитивности, т.е.:
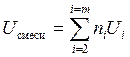 .
(2.1)
.
(2.1)
Простая система изотропна, т.к. ее физические характеристики не зависят от направления. В настоящем пособии, если не оговорено особо, рассматриваются простые системы.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.