На основании уравнений (2.74) химический потенциал можно представить как частную производную от любой термодинамической функции состояния по количеству i- го вещества при постоянном количестве остальных индивидуальных веществ и постоянстве соответствующих термодинамических параметров (p, V, T) то есть:
 (2.75)
(2.75)
Весьма приближенно физический смысл химического потенциала можно интерпретировать следующим образом:: химический потенциал любого компонента показывает насколько увеличивается значение термодинамической функции, характеризующей данную систему, при прибавлении к ней некоторого количества этого компонента.
Условно величину химического потенциала относят к молю вещества.
Следует отметить, что в общем случае величина miзависит от содержания всех составляющих систему веществ. Однако для идеального газа допускают независимость химического потенциала от содержания других компонентов, т.е. mi =f(p,T, N1, N2, ....Nk). Это означает, что
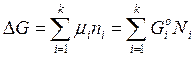 (2.76)
(2.76)
Для произвольного давления идеального газа можно записать.
mi(T) = mi0(Т) + RT ln pi, (2.77)
где pi – парциальное давление компонента i в смеси, mi0 – значение mi при pi=1 бар.
В случае раствора последнее уравнение будет иметь вид:
mi(T) = mi0(Т) + RT ln ai, (2.78)
где ai – активность вещества; ai = yici, где yi – коэффициент активности, который характеризует степень отклонения свойств рассматриваемого компонента в данном растворе от свойств его в соответствующем простейшем растворе; ci – аналитическая концентрация растворенного вещества.
КОНТРОЛЬНОЕ ЗАДАНИЕ И ВОПРОСЫ
· Какая именно работа должна использоваться в качестве критерия равновесия и самопроизвольности процесса?
а) Максимальная работа расширения.
б) Фактическая работа расширения.
в) Фактическая полная работа.
г) Максимальная полная работа.
· Химическая реакция СО + 2 Н2 ↔ СН3ОН (Г) протекает при 298 К и давлении 1 атм (101325 Па). Выберите правильное утверждение:
a. Реакция протекает самопроизвольно в прямом направлении.
b. Реакция протекает самопроизвольно в обратном направлении.
c. Система находится в равновесии.
d. Реакция невозможна в принципе (в любом направлении).
· Может ли уменьшиться энтропия термодинамической системы в результате самопроизвольного протекания в ней химической реакции (при постоянных давлении и температуре)? См вариант для гальванич цепи?
1. Как изменится энтропия идеального газа при равновесном изотермическом сжатии?
2. Объясните, в чем проявляется статистический характер второго закона термодинамики.
3. На основе известных значений стандартной энергии Гиббса для реакций окисления титана и кремния определите, возможно, или нет окисление титана, если его нагревание выполнять в тигле, содержащем SiO2.
4. Что такое внутренняя энергия? В каком случае внутренняя энергия служит термодинамической функцией?
5. Что такое термодинамические функции? В чем состоит методическая целесообразность применения термодинамических функций?
6. Сформулируйте принцип положительной работы (по Нернсту). Как используется этот принцип в термодинамике для решения химических задач?
7. В чем заключается физический смысл “химического потенциала”?
8. Чему равно изменение энергии Гельмгольца при обратимом испарении 1 кг воды.
9. Определите изменение энтропии для 5 моль олова. Примите, что для данной модификации молекула олова состоит из одного атома, Тпл = 505 К, а теплота плавления составляет 7,2 кДж/моль.
10. В одном из сосудов одинакового объема 5 м3 находится 10 кг азота в другом - 30 кг кислорода. В обоих сосудах температура одинакова. Найдите изменение энтропии при диффузии в результате соприкосновения содержимого этих сосудов.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.