Здесь (¶DH/¶T)R – температурный коэффициент теплового эффекта реакции. Производные (¶DH2/T)R и (¶DH1/¶T)Rпо сути являются теплоемкостями. Поэтому величина DCP является разностью между теплоемкостями системы в конечном и начальном состояниях.
На основании выражения (2.30) можно сформулировать закон Кирхгофа:
Температурный коэффициент теплового эффекта равен изменению теплоемкости системы, происходящему в результате процесса.
Переходя к полным дифференциалам, получаем формулу:
dDH=DCpdT (2.31)
Теплоемкость (С) – количество теплоты, которое необходимо подвести к телу, чтобы повысить его температуру на 1 К.
Математически теплоемкость определяют как отношение
количества теплоты, полученной телом (веществом) при бесконечно малом
изменении его состояния в каком-либо процессе к вызванному им приращению температры,
т.е.: ![]()
Поскольку количество теплоты зависит от пути процесса, различают теплоемкости соответственно конкретным условиям . Поэтому можно записать:
p = const:  и
V = const:
и
V = const: 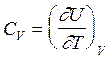 (2.32)
(2.32)
Эти выражения применимы как к чистому веществу, так и к любой гомогенной системе с постоянным составом.
Теплоемкость, отнесенная к количеству вещества равному молю называется молярной теплоемкостью. Молярную теплоемкость вещества, находящегося в стандартном состоянии обозначают: Сро(Т) или Cvo(T). Молярная теплоемкость имеет единицу измерения -Дж/(моль×К).
Теплоемкость, отнесенная к единичной массе, называется удельной теплоемкостью[18]. Удельная теплоемкость смеси веществ (С), измеренная при постоянном давлении, подчиняется закону аддитивности. Поэтому
 (2.33) где m1…..mn ,
а также mi -
массы компонентов смеси; С1 …..Сn – иассовые удельные теплоемкости отдельных компонентов смеси.
(2.33) где m1…..mn ,
а также mi -
массы компонентов смеси; С1 …..Сn – иассовые удельные теплоемкости отдельных компонентов смеси.
Часто при оценке энергетической ценности продуктов питания принимают, что эти продукты состоят из W частей воды и (1- W) частей сухих веществ. Это позволяет рассчитать теплоемкость продукта С(прод) по формуле :
С(прод) = Сw×W + C(сух.) ×(1-W)
В расчетах обычно учитывают, что теплоемкость сухих веществ для продуктов животного происхождения составляет примерно 1,38 ÷1,68 кДж/(кг∙К), растительного – 0,7 ÷ 1,3 кДж/(кг∙К),
В общем случае теплоемкость зависит от температуры. В области температур от комнатной до 1500 К эту зависимость можно описать выражением:
Сро(Т) = ао +а1Т + а2Т2 + а3 Т3 +....... (2.34)
где ai - коэффициенты, которые определяются экспериментально.
Стандартные энтальпии образования DfH°(298) кДж/моль для некоторых соединений и их молярные теплоемкости, выраженные уравнением (2.34), приведены в таблице 2.6.
Таблица 2.6
Стандартные энтальпии образования DfH°(298) кДж/моль соединений и молярные теплоемкости Сро(Т) = ао +а1Т + а2Т2 + а3Т3 кДж/моль
|
Соединение |
DfH°(298) кДж/моль |
ао |
а1×103× |
а2×107 |
а3×109 |
Интервал температур, °K |
|
С (графит) |
0 |
0,96 |
0,27 |
0 |
0 |
298 - 2000 |
|
СО (г) |
-110,5 |
1,62 |
0,23 |
0 |
0 |
298 - 2000 |
|
СО2 (г) |
-393,51 |
2,52 |
0,50 |
0 |
0 |
298 - 2000 |
|
Н2О (г) |
-241,84 |
1,72 |
0,56 |
0,64 |
0 |
298 - 1500 |
|
Н2О (ж) |
-285,84 |
- |
- |
- |
- |
- |
|
Н2S (г) |
-20,15 |
1,66 |
0,88 |
1,77 |
0 |
298 - 1500 |
|
NH3 (г) |
-46,19 |
- |
- |
- |
- |
- |
|
O2 (г) |
0 |
1,47 |
0,74 |
- 2,20 |
0 |
298 - 1500 |
|
SO2 (г) |
-296,90 |
1,62 |
2,77 |
- 0,72 |
0,49 |
298 - 1500 |
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.