При протекании n циклов получается побочная реакция
(с O2 воздуха):
(NH4)2SO3 + 0,5O2 ® (NH4)2SO4
Каталитическая очистка газов от диоксида серы.
Серосодержащие газы, очищаются от твердых включений и при температуре 4500С и далее подаются в реактор, где на ванадиевом катализаторе протекает реакция:
2SO2 + O2 ® 2SO3
Далее газы охлаждаются до 2300С и в скруббере промываются раствором серной кислоты с образованием олеума.
Процесс используется при высокой концентрации SO2 и низком объеме очищаемого газа. В другом случае вместо промывки SO3 вводят газообразный аммиак, который в присутствии кислорода воздуха образует реакцию:
SO3 +NH3+ Н2O ® (NH4)2SO4
Методы, лежащие в основе очистки газов от оксидов азота.
Отходящие газы, содержащие оксиды азота, образуются в ряде производств химической промышленности (нефтеперегонка, сжигание топлива, транспорт). Известны следующие оксиды азота:
N2O – закись азота «веселящий газ» (температура разложения 900 °С)
NO – оксид азота (не реагирует с водой, не улавливается, образуется на ТЭС)
N2O3 – (NO+NO2) существует при низкой температуре
NO2 – диоксид азота (образуется при окислении NO кислородом, устойчив до температуры 400°С, сильный окислитель)
N2O4 –очень сильный окислитель (исп. в ракетной технике)
N2O5 – твёрдое вещество, сильный окислитель, N2O5 + H2O ®2HNO3
На практике имеют дело с NO и NO2. Методы очистки от этих оксидов делятся на:
· Сухие,
· Мокрые:
- процессы без регенерации абсорбента.
- процессы с регенерацией абсорбента.
Большинство процессов сухой очистки основано на использовании реакции четного каталитического или термического разложения при температурах от 300°С до 1000 °С.
- селективное каталитическое восстановление аммиаком
- селективное высокотемпературное восстановление
- неселективное каталитическое восстановление.
Наибольшее число разработок приходится на газообразные методы, особенно на селективное каталитическое разложение с помощью аммиака.
Недостаток в том, что на всех стадиях технического процесса приходится иметь дело с большими объёмами газов (1 млн м3/час и более), требует больших капитальных затрат.
Для мокрых способов большие объёмные аппарата необходимы только на стадии промывки газов. На стадии утилизации оксидов азота требуются сравнительно небольшие аппараты.
Отсюда обозначилась тенденция роста числа разработок в области мокрой очистки газа от оксида азота.
Методы мокрой очистки.
1. Метод абсорбции водой.
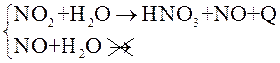
Добавление в раствор перекиси водорода (5-10%):
![]()
2. Использование кислорода воздуха в качестве окислителя:
![]()
Окислитель может быть в газовой фазе или в жидкой. Скорость окисления в жидкой фазе выше (≈в 600 раз)
3. Использование озона:
![]()
![]() очень интенсивно
взаимодействует с водой:
очень интенсивно
взаимодействует с водой:
![]()
Недостатки:
- генерация озона – дорогостоящий процесс
- озон необходимо подавать с 1,5-2,0 избытком
- озон необходимо разлагать в остаточных газах
4. Абсорбция водными растворами щелочей.
NO2 + Na2CO3®NaNO3 + CO2 +Q
Сравнительная оценка щелочных поглотителей при абсорбции оксидов азота. ( NO+NO2)
KOH > NaOH > Ca(OH)2 > Na2CO3 > К2CO3 >NaHCO3 > KHCO3 > MgCO3> ВаCO3
1,0 0,84 0,8 0,78 0,68 0,51 0,44 0,4 0,4
>CaCO3 > Mg(OH)2
0,39 0,35
Начальная концентрация: 100 г/л.
Время контакта: 10 мин.
При абсорбции аммиаком образуется нитрит аммония NH4NO2, который разлагается на N2 и H2O при температуре > 56°С.
NO+NO2 +2NH4OH®5H2O + 2N2
Абсорбционно - окислительный метод.
NO + NO2 = 1:1
NO + NO2 = 9:1
Необходимо NO окислить до NO2. Используют растворы окислители, которые могут быть представлены в виде ряда:
KBrO3 > KMnO4 > H2O2 > Na2CrO4 > (NH4)2Cr2O7 > K2Cr2O7.
NO + H2O2®NO2 + H2O
2NO + O3®N2O5
Получают озон при электрических разрядах
3O2®2O3
Установка денитрификации газов:
Производительность: 2700 м3/час
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.