- поверхности с чисто химической адсорбцией: катализаторы.
Классификация веществ в зависимости от легкости сорбируемости:
- высокая: до 50 % масс. (поглощение бензола на акт. угле)
- удовлетворительная: 10 ¸ 25 % масс.
- слабая: 3 ¸ 10 % масс.
- низкая: < 1 % масс.
Характеристики сорбента:
- твердость
- механическая прочность
- многократность использования
- простота регенерации
- склонность к слеживанию
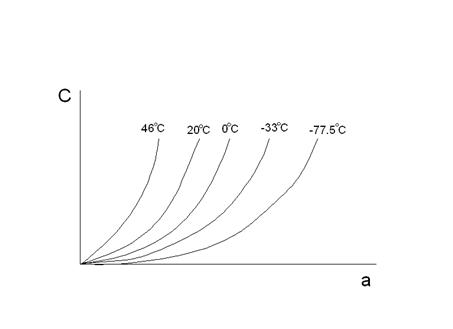
Количество вещества, адсорбированного единицей массопоглотителя, зависит от температуры и концентрации поглощаемого вещества для каждого типа адсорбента:
х = f(![]() ; T).
; T).
х = f(Y) при Т = const
Зависимость количества поглощённого вещества от количества поглощаемого вещества при постоянной температуре называется изотермой.
Изотермы определяются только опытным путём.
Вид изотермы зависит от:
- удельной поверхности
- объёма пор
- их распределения по размерам
- свойств поглощаемого вещества
- температуры процесса.
Адсорбция всегда сопровождается понижением давления поглощаемого вещества над поглотителем и выделением тепла.
По принципу Ле-Шателье повышение температуры процесса и понижение давления не способствует процессу адсорбции.
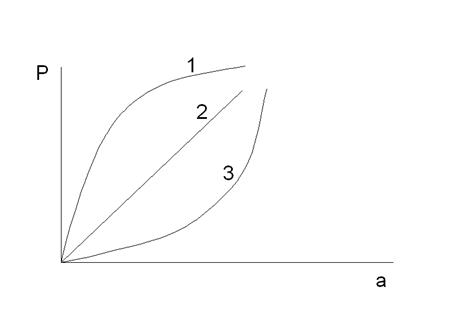
1 – выгнутая
2 – линейная
3 – выгнутая (десорбция)
Уравнение Генри:
a = k × P (прямая) при малых значениях Р.
Уравнение Фрейндлиха: (1906 г)
a = k × Pn
k, n – const, характеризующие процесс адсорбции.
ограниченный характер уравнения.
Уравнение Лэнгмюра:
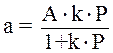 .
.
Поверхность адсорбента представляет собой набор энергетически одинаковых активных центров, на которых и локализуются молекулы улавливаемого вещества. На первом активном центре может локализоваться 1 молекула улавливаемого вещества. Взаимодействием между уловленными молекулами пренебрегают.

Уравнение Лэнгмюра – уравнение мономолекулярной адсорбции.
k∙Р ![]() 1 Þ a = k×P
1 Þ a = k×P
k∙Р ![]() 1 Þ a = A
1 Þ a = A
A – предельная степень насыщения адсорбента.
Теория полимолекулярной адсорбции:
Теория Эйлена и Поляни: при температуре ниже критической каждая молекула, адсорбированная в первом слое поглотителя является центром для образования второго и третьего слоев и т.д. Вблизи поверхности адсорбента существует потенциальное адсорбированное силовое поле, убывающее с расстоянием. Заканчивается всё капиллярной конденсацией в слое адсорбента.
Уравнение Дубинина:
Дубинин предположил, что полимерная адсорбция существует только в макропорах; в мезопорах – объёмное поглощение; в микропорах – капиллярная конденсация.
Уравнение Дубинина – Радушкевича:
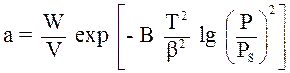
а – количество поглощенного вещества
W – суммарный объём пор сорбента
V – объём поглощаемого вещества
B – коэффициент, характеризующий природу адсорбента
T – температура процесса, °К
b - коэффициент аффинности – отношение молекулярных объёмов изучаемого и стандартного вещества (бензол)
P – парц. давление сорбируемого компонента
PS – нас. давление сорбируемого компонента при температуре Т.
Адсорбция на поверхности поглотителя происходит в несколько стадий:
1. Перенос молекул газа к внешней поверхности адсорбента (внешняя диффузия).
2. Молекулы газа проникают в поры твёрдого вещества.
3. Адсорбция молекул в определенной части поверхности пор .
4. Диффузия адсорбированной молекулы внутрь зерна.
Удаление молекул с поверхности требует подвода тепла и испарение молекул. В случае с хемосорбцией одновременно могут быть удалены и некоторые атомы поглотителя, что ведет к изменению природы поверхности и уменьшению абсорбционных способностей.
Если бы скорость поглощения молекул поверхностью поглотителя была бесконечно большой, то адсорбция в последующих слоях поглотителя происходила бы после полного насыщения предыдущих слоёв. Однако скорость массопередачи конечна и распределение поглощаемого вещества по высоте слоя происходит плавно с образованием так называемого фронта адсорбции.
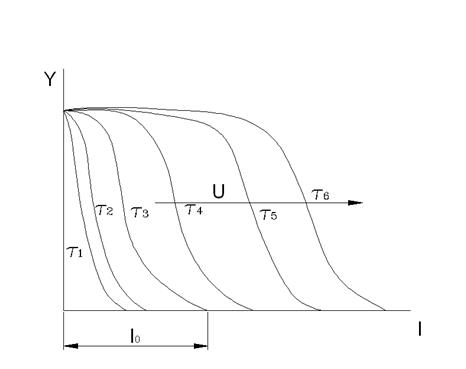
Y – концентрация поглощаемого вещества в газе (растворе)
l – длина неподвижного слоя адсорбента
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.