Характерные реакции аммиака:
как основания:
![]()
![]() =
=![]() (5.1)
(5.1)
как восстановителя:
![]()
![]() =-
=-![]() (5.2)
(5.2)
как комплексообразователя:
![]()
![]() =
=![]() (5.3)
(5.3)
Аммиак хорошо растворим в воде, однако его раствор содержит малое количество ионов:
![]()
![]()
![]() (5.4)
(5.4)
Ион аммония не проявляет
восстановительных и комплексообразующих свойств. Кроме того, константа
диссоциации аммиака с ростом температуры уменьшается, количество ионов ![]() и
и ![]() уменьшается,
а количество аммиака увеличивается, следовательно, растут комплексообразующие
свойства. Комплексообразование приводит, в свою очередь, к изменению потенциала
среды. В процессе комплексообразования изменяется и
окислительно-восстановительный потенциал среды:
уменьшается,
а количество аммиака увеличивается, следовательно, растут комплексообразующие
свойства. Комплексообразование приводит, в свою очередь, к изменению потенциала
среды. В процессе комплексообразования изменяется и
окислительно-восстановительный потенциал среды:
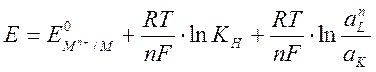 (5.5),
(5.5),
где Е- потенциал реакции комплексообразования; Е0- стандартный потенциал реакции; КН-константа нестойкости комплексного соединения; аLn и аК- активности лигандов и комплексных ионов; n-стехиометрические коэффициенты лигандов в электродной реакции; F – число Фарадея; R- газовая постоянная; Т –абсолютная температура.
Для медьсодержащих сплавов оптимальным является значение рН=7,5¸9,0, скорость коррозии меди минимальна при рН=8¸8,5 для концентраций кислорода 10-20 мкг/дм3 при низкой электропроводности среды.
В конденсате тракта ПНД при ГАВР всегда присутствуют значительные количества аммиака и некоторое количество кислорода, в тоже время отсутствует гидразин. Эти условия и приводят к значительной коррозии медьсодержащих сплавов, поскольку аммиак в присутствии кислорода взаимодействует с медью, образуя аммиачные комплексы меди. Эти комплексы меди в температурной области 155-265 0С могут взаимодействовать по электрохимическому механизму с металлическим железом:
![]() (5.6)
(5.6)
Протекание этой реакции должно приводить к увеличению содержания железа в питательной воде. Увеличение содержания железа в питательной воде и одновременно снижение концентрации меди в этом тракте являются, по-видимому, взаимосвязанными процессами, причем более положительный потенциал меди по сравнению с железом может приводить к электрохимическому процессу:
![]() (5.7)
(5.7)
![]() (5.8)
(5.8)
В соответствии с
уравнениями (5.6)-(5.8) физико-химические процессы взаимодействия железа, меди
и аммиака приводят к частичному осаждению меди в ПВД и выносу железа и меди в
барабан с дальнейшим осаждением этих продуктов на поверхностях нагрева. Не
исключено, что аммиак может образовывать с железом комплексный катион ![]() , который в теплоносителе может быть
источником гидроокисей по схеме:
, который в теплоносителе может быть
источником гидроокисей по схеме:
![]() (5.9)
(5.9)
Избыток ионов аммония в растворе способствует растворению гидроокисей двухвалентного железа в отсутствие кислорода по схеме:
![]() (5.10)
(5.10)
В соответствии с уравнениями (5.9),(5.10) в теплоносителе должна поддерживаться повышенная концентрация железа. Это подтверждает нецелесообразность дозировки аммиака для поддержания рН=9,1±0,1.
На современных тепловых электростанциях до сих пор остается значительное количество энергоблоков с барабанными котлами, работающих при ГАВР. Этот режим широко распространен в теплоэнергетике благодаря многолетнему его применению.
Впервые, гидразин стал применяться для химического обескислораживания питательной воды котлов в 40-х годах в Германии.
Гидразин применяется на станциях в качестве восстановителя, помогает образованию защитной пленки. Максимальные восстановительные свойства гидразина проявляются при температурах около 150 0С и при рН=9411 (до тракта питательной воды высокого давления и экономайзеров котлов), поэтому легко вступает во взаимодействие с растворенным кислородом и другими окислителями, тем самым предотвращая кислородную коррозию оборудования пароводяных контуров, работающих при коррекционных ВХР. При понижении рН гидразин не предупреждает коррозию, а несколько усиливает ее вследствие образования перекиси водорода. Максимальный ингибирующий эффект гидразина наблюдается при температуре около 150 0С, т.е. до тракта питательной воды высокого давления и экономайзеров котлов, в пределах нахождения конденсата и питательной воды в системах регенерации низкого давления от конденсаторов турбин до деаэраторов питательной воды.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.