е) Еквівалентна маса елемента у сполуках визначається з співвідношення МЕ(ел) = А/n, де А – атомна маса елемента, n – його валентність у сполуці. Наприклад, МЕ(О) = 16/2 = 8 г/моль.
ж) Еквівалентна маса сполуки складається з еквівалентних мас складових.
Наприклад, MЕ(MgSO4) = ME(Mg2+) + ME(SO42-) = 12 + 49 = 61 (г/моль)
Наведені приклади показують, що еквівалент речовини залежить від реакції, в якій вона бере участь.
В деяких випадках корисно користуватися значенням еквівалентного об¢єму, тобто об’єму, який займає за даних умов 1 еквівалент газової речовини. Так, еквівалентний об’єм водню за н.у. VE (H2) дорівнює 11,2 л/моль (тому що 1 моль атомів Н складає 0,5 моля Н2, а 1 моль Н2 займає об’єм 22,4 л), кисню - 5,6 л/моль.
Приклад 3. Визначити атомну масу двовалентного металу, якщо 8,34 г металу окиснюються 0,68 л кисню (н.у.).
Розв’язок:
1. МЕ(Ме) - ?
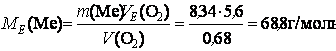 |
|||
2. А (Ме) - ?
МE(ел) = A/n, A = МE (ел). n = 68,8 . 2 = 137,6 г/моль.
Відповідь: атомна маса металу дорівнює 137,6 г/моль.
Питання і задачі:
1. Сформулюйте стехіометричні закони. Вкажіть відхилення від них.
1. 2. Що називається
еквівалентом? Що таке еквівалентна маса?
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.