Розв’язок:
Комплексоутворювач Cu2+ має таку електронну конфігурацію валентного рівня: [Cu 2+] = 3d94s04р0
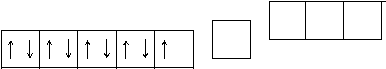
Сu 2+ мають чотири вакантні орбіталі – одну 4s і три - 4р. Вони є акцептора- ми електронів.
 |
|||
3d 4s 4p
Ці електронні орбіталі гібридизуються (відбувається sp3-гібридизація), причому утворюється тетраедричний комплексний іон.
Молекула амоніаку має одну неподілену пару електронів і є донором електронів:
. .
Н : N : Н.
Н
При взаємодії Сu 2+ з чотирма молекулами амоніаку виникають чотири донорно-акцепторні зв’язки і утворюється комплексна сполука, електронну конфігурацію якої згідно з теорією валентних зв’язків можна зобразити таким чином:
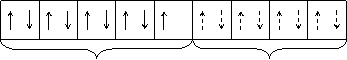
3d sp3
Тут електрони, які належали іону Сu 2+, показані суцільними стрілками, а ті, які належали молекулам амоніаку, – пунктирними.
Дисоціація і стійкість комплексних сполук.
Іони зовнішньої сфери зв’язані з комплексом в основному силами електростатичної взаємодії (тобто іонним хімічним зв’язком) і в розчинах дисоціюють подібно сильним електролітам. Ця дисоціація називається первинною і відбувається майже повністю:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.