[Cu(NH3)4]SO4 « [Cu(NH3)4] 2+ + SO4 2-.
Поряд з цим процесом в незначному ступені відбувається дисоціація внутріш-ньої сфери комплексу, в якої ліганди пов¢язані з комплексоутворювачем ковалентними зв’язками, утвореними внаслідок донорно-акцепторної взаємодії:
[Cu(NH3)4] 2+ « Cu2+ + 4 NH3.
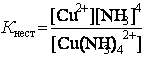 |
Значення констант нестійкості коливаються в широких межах і є мірою стійкості комплексів. Чим стійкіше комплексний іон, тим менше його константа нестійкості. Так, серед однотипних сполук:
[Ag(NO2)2]- (К нест = 1,3 .10-3);
[Ag(CN)2]- (К нест = 1. 10-21);
[Ag(NH3)2]+ (К нест = 6,8 .10-8);
[Ag(S2O3)2]3- (К нест = 1.10-13),
найбільш стійким є комплекс [Ag(CN)2]- , а найменш - [Ag(NO2)2]-.
Значення констант нестійкості надаються в таблицях.
Приклад 3. Визначити концентрацію Ag+ в 0,005М розчині К[Ag(CN)2], який вміщує, крім того, 0,01 моля КCN в 1 л розчину.
Розв’язок:
Дисоціація комплексу відбувається за рівнянням:
[Ag(CN)2]- « Ag+ + 2CN- .
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.