Закон еквівалентів. Молекулярні сполуки реагують у кількостях, пропорційних їх еквівалентам. При відсутності молекулярної структури у даному агрегатному стані їх кількості можуть відхилятися від хімічних еквівалентів.
Хімічним еквівалентом (еквівалентом) речовини (Е) називають таку її кількість, яка поєднується з одним молем атомів Гідрогену, або заміщує таку ж кількість атомів Гідрогену у хімічних реакціях. Розмірність еквівалента – моль. Наприклад, Е(О) = 0,5 моля, оскільки Оксиген у бінарній сполуці Н2О поєднується з двома молями атомів Гідрогену.
Еквівалентною масою (МЕ) називається маса одного еквівалента речовини. Розмірність еквівалентної маси – г/моль. Наприклад, МЕ(О) = 8 г/моль.
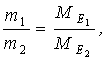 |
де m1 i m2 - маси реагуючих речовин, МЕ1 І МЕ2– їх еквівалентні маси.
Приклад 1.Визначити еквівалент і еквівалентну масу Сульфур у Н2S.
Розв’язок:
1. Е(S) -- ?, МЕ (S) - ?
У дигідроген сульфіді H2S 2 моля атомів Гідрогену сполучаються з 1 молем атомів Сульфуру або 1 моль атомів Гідрогену сполучається з 0,5 моля атомів Сульфуру. Згідно з визначенням, еквівалент Сульфуру Е(S) дорівнює 0,5 моль, а еквівалентна маса МЕ (S) = 0,5 .32 = 16 г/моль.
Відповідь: Е(S) - 0,5 моль, МЕ (S) – 16 г/моль.
Еквівалент і еквівалентну масу елемента можна визначити за складом його сполуки з іншим елементом, еквівалент якого відомий.
Приклад 2. При згорянні 5 г металу утворюється 9,44 г оксиду металу. Визначити еквівалентну масу металу.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.