Подлинность:
1) ИК-спектр
2) УФ спектр в 0,1 М NaOH l max = 258, 303, 271
Количественное определение: ВЭЖХ
Фармакологическое действие: противоопухолевое (цитостатическое)
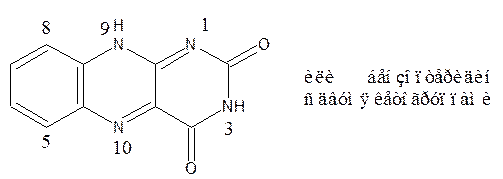
Впервые в 1933 г. (Кун и сотр.) было выделено в виде желтого пигмента из молочной сыворотки веществ, названное лактофлавином («флавус», лат. - желтый). В дальнейшем подобные желтые пигменты (флавины) были выделены из яичного белка, лимонов и т.д. После установления в молекуле лактофлавина сахара рибозы название лактофлавин заменили на рибофлавин (В2).
В 1937 г. Нобелевская премия по химии была присуждена Паулю Карреру за исследование каротиноидов и флавинов (витамины А и В2). Установил структуру В2.
В 1938 г. Нобелевский комитет по химии принял решение вновь присудить премию исследователю, занимающемуся каротиноидами и флавинами. Это был немецкий химик Рихард Кун, так как установил, что желтый пигмент дрожжей и лактофлавин идентичны В2. Кстати, Кун выделил и определил состав и структуру В6.
Рибофлавин встречается в природе в животных и растительных тканях, наиболее богаты им дрожжи, печень, почки, пшеница, ячмень, томаты. Выделение рибофлавина из природных источников сложный процесс с низким выходом продукта. Поэтому в настоящее время В2 получают исключительно синтетическим путем.
Рибофлавин в промышленном масштабе синтезируют из О-ксилидина, D-рибозы и аллоксана.
6,7-диметил-9-(D-1-рибитил)-изоаллоксазин

М.Negwer дает и другое название:
7,8-диметил-10(D-рибо-2,3,4,5-тетрагидроксипентил)-изоаллоксазин
Наличие сопряженных двойных связей обусловливает ярко-желтую окраску соединения. Мало растворим в воде, растворим в HCl, хорошо растворим в NaOH. Удельное вращение от –110 до –130о (в 0,5% КОН).
Химическая структура рибофлавина высокоспецифична, даже незначительные ее изменения вызывают потерю витаминной активности. Проявление витаминной активности связано с наличием в изоаллоксазиновом кольце лабильной группировки с двумя сопряженными двойными связями. Эта группировка обусловливает окислительно-восстановительные свойства рибофлавина.
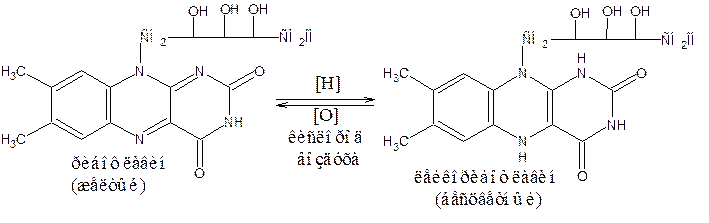
Рибофлавин имеет амфотерный характер. Кислотыне свойства обусловлены подвижным атомом водорода (положение 3) имидной группы, а основные – гетероциклическими атомами азота. Поэтому он растворим в растворах щелочей, хлороводродной и уксусной кислотах. Как азотистое органическое основание рибофлавин дает реакции с осадочными общеалкалоидными реактивами, например, реактивом Драгендорфа.
Гидроксильные группы рибитильной цепочки обусловливают образование сложных эфиров, в частности, с концентрированной серной кислотой (моно-, ди-, три-, тетрасульфоксильные эфиры рибофлавина).
Характерной особенностью рибофлавина является большая светочувствительность. Под влиянием света происходят глубокие изменения в химической структуре рибофлавина, зависящие от рН среды, в результате чего образуются люмихром и люмифлавин:
Рибофлавин
![]() hn
hn
в нейтральной или
слабокислой среде в щелочной среде
![]()
![]()
![]()

люмихром люмифлавин
желтое окрашивание, та же окраска и флюоресценция, но не флюоресцирует что и у рибофлавина, но растворяется в хлороформе
Люмихром и люмифлавин могут оказаться нежелательной примесью в рибофлавине при неправильном хранении препарата. Определяют люмифлавин, не больше эталона.
Рибофлавин в кислых растворах в темноте устойчив. В щелочных растворах при нагревании превращается в замещенную хиноксалинкарбоновую кислоту с расщеплением пиримидиновго цикла.
Растворимость: мало растворим в воде и спирте. РН растворов 5,0-7,0.
Подлинность. В2 ГФ Х рекомендует устанавливать по характерной зеленовато-желтой окраске и интенсивной зеленой флюоресценции водного раствора (в УФ-свете). Если к водному раствору рибофлавина добавить гидросульфит натрия (сильный восстановитель), то окраска и флюоресценция исчезнет вследствие образования лейкорибофлавина.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.