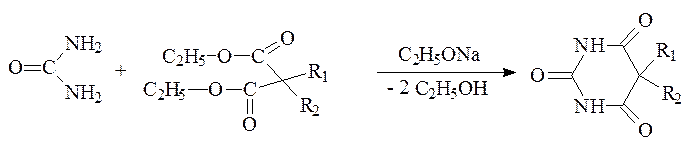
Синтез производных барбитуровой кислоты продолжается. Среди огромного числа (нескольких тысяч) производных барбитуровой кислоты выявлено разнообразное терапевтическое действие: гипотензивное, спазмолитическое, анальгетическое, антисептическое, антитиреоидное.
Снотворное действие барбитуратов связано с их способностью вызывать иррадицию тормозного процесса в коре головного мозга. При больших дозах понижаются процессы возбуждения. Наряду с влиянием на кору весьма выражено действие на стволовую часть мозга. Разные барбитураты обладают различной продолжительностью действия, что связано с особенностями их превращения в организме и выделения из него. При длительном применении может развиться привыкание к барбитуратам.
1) Увеличение числа углеродных атомов до 5-6 в алифатической цепи в положении 5 приводит к усилению физиологического действия. Дальнейшее увеличение цепи уменьшает активность (барбитал-барбамил-фенобарбитал)
2) Замена одного этильного радикала на фенильный (барбитал – фенобарбитал) приводит к усилению снотворного эффекта и одновременно придает препарату противосудорожное действие
3) Замена радикала с нормальной цепью углеродных атомов на радикалы с разветвленной цепью усиливает действие препарата, но одновременно сокращает время его действия (барбитал – барбамил; длительного действия – средней продолжительности действия)
4) Введение галогенов, наличие непредельных радикалов усиливает фармакологическую активность барбитуратов
5) При одновременном замещении водородов у обоих атомов азота появляется свойство вызывать судороги
6) Тиобарбитураты менее стойки, чем их кислородные аналоги, и поэтому действуют более кратковременно
Все барбитураты относятся к списку Б, отпуск их должен производиться строго по рецептам.
Применяют внутрь, внутримышечно, внутривенно и ректально.
Поскольку барбитураты отличаются в основном характером радикалов у углерода в С5 имеется много общего в физических, химических свойствах и методах анализа.
Барбитураты представляют собой кристаллические вещества белого цвета, иногда слегка желтоватого (в основном тиобарбитураты). Имеют индивидуальные температуры плавления.
Кислые формы барбитуратов мало растворимы в воде, нерастворимы в кислотах, легко растворимы в растворах едких щелочей. Растворяются в некоторых органических растворителях: спирте, хлороформе, этилацетате. Барбитураты-соли хорошо растворимы в воде.
При нагревании барбитураты возгоняются, не разлагаясь. Идентифицируют по УФ-спектрам и реакциям, обусловленным химическими свойствами.
I. Барбитураты, обладая кислыми свойствами, образуют соли со щелочами. Практически существуют только однозамещенные соли щелочных металлов (препараты – гексенал, тиопентал-натрий). Лактимная форма (однозамещенные натриевые соли) легко образуется при рН = 9,8-10,5, а дилактимная при рН>11:
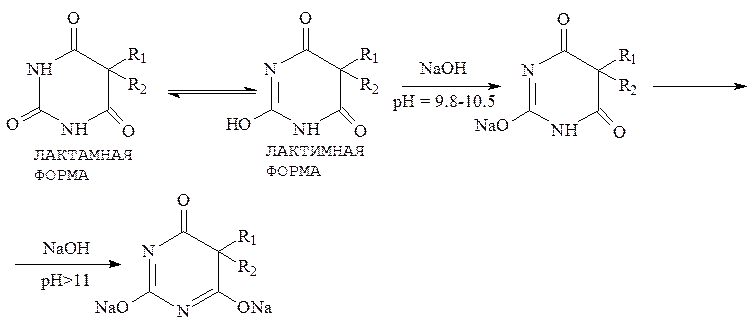
Реакция взаимодействия кислотных форм барбитуратов со щелочью применяется для их количественного определения, чаще во внутриаптечном контроле.
Протофильные растворители усиливают кислотные свойства производных барбитуровой кислоты (ДМФА или смесь ДМФА с бензолом), что используется в анализе.
Натриевые соли барбитуратов, как соли, образованные сильным основанием и слабой кислотой легко разрушаются минеральными кислотами, в результате чего выделяется в осадок кислотная форма, которую можно идентифицировать по температуре плавления.
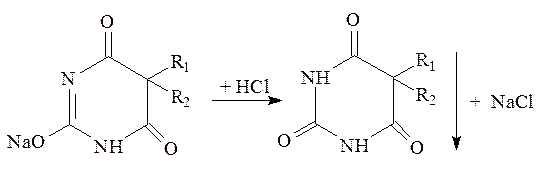
Следует помнить, что как кислоты барбитураты слабее угольной кислоты, т.е. угольная кислота вытесняет кислотные формы из соответствующих натриевых солей. Это учитывается при приготовлении жидких лекарственных форм: дистиллированная вода должна быть свежепрокипяченой. Натриевые соли нельзя стерилизовать.
Кислотный характер производных барбитуровой кислоты используется в реакциях подлинности, а именно в реакциях комплексообразования с ионами серебра, кобальта и меди:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.