а) с нитратом серебра – для кислотных форм реакцию проводят в среде карбоната натрия. Моносеребряные соли растворимы в воде, дисеребряные – выпадают в осадок.
Исключение – гексенал и бензонал, имеют заместители в положении N1, поэтому белый осадок моносеребряной соли выпадает сразу.
Реакция с нитратом серебра используется для количественного определения барбитуратов во внутриаптечном контроле (без индикатора – до образования устойчивой при взбалтывании мути белого цвета).
б) с нитратом кобальта – все барбитураты дают растворимые в воде комплексы сине-фиолетового цвета, т.е. это общая реакция. Для устойчивости комплекса добавляют спирт и хлорид кальция; кислотные формы сначала переводят в натриевые соли добавлением гидроксида натрия.
При выполнении реакций комплексообразования следует обращать внимание на реакцию среды, так как даже при незначительном избытке щелочи происходит образование гидроксидов меди (II), кобальта (II) и оксида серебра, маскирующих окраску комплексов.
II. Деструкция производных барбитуровой кислоты а) полная деструкция – при сплавлении с кристаллическим гидроксидом натрия происходит разрушение молекулы:
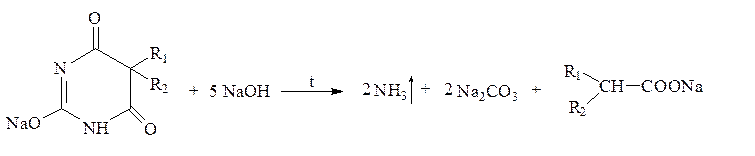
При подкислении продуктов реакции хлористоводородной кислотой идут реакции:
![]() Na2СО3 + 2 HCl 2
NaCl + СО2 + Н2О
Na2СО3 + 2 HCl 2
NaCl + СО2 + Н2О
![]()
![]() R1 R1
R1 R1
![]()
![]()
![]() CH – COONa + HCl CH – COOH + NaCl
CH – COONa + HCl CH – COOH + NaCl
R2 R2 запах
б) частичная деструкция – при длительном стоянии натриевых солей в растворах щелочей или при нагревании их водных растворов происходит частичная деструкция молекулы с образованием различных уровых кислот:
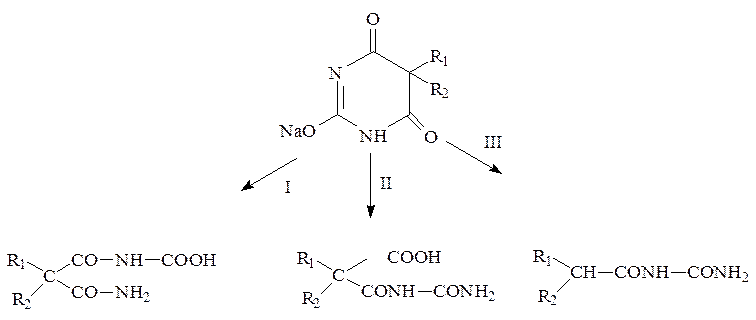
Поэтому натриевые соли нельзя стерилизовать.
III. Реакции конденсации барбитуратов
Барбитураты вступают в реакцию конденсации с альдегидами в присутствии конц. серной кислоты с образованием окрашенных продуктов.
Например:
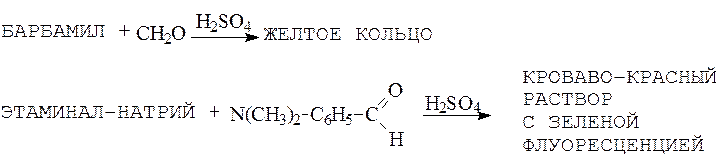
IV. Реакции, обусловленные особенностями химической структуры
Фенобарбитал: в положении 5 имеется фенильный радикал, поэтому возможны реакции электрофильного замещения в ароматическом ядре, например нитрование. Нитропроизводное можно восстановить до первичного ароматического амина, а затем получить азокраситель:
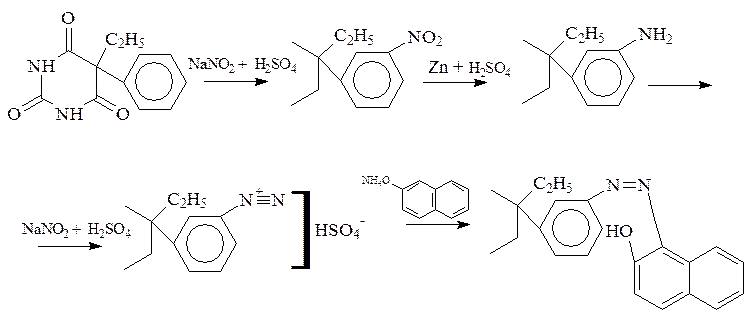
Эту реакцию дает и бензонал.
Бензонал: в положении N1 имеет остаток бензойной кислоты, поэтому после щелочного гидролиза выделяется бензоат натрия, для которого характерна реакция комплексообразования с хлоридом железа (III):
![]()
![]() 6C6H5COONa + 2FeCl3 +
10H2O
6C6H5COONa + 2FeCl3 +
10H2O
(C6H5COO)3Fe * Fe (OH)3 * 7H2O (осадок телесного цвета) + 3C6H5COOH + 6NaCl
Реакцию следует проводит в нейтральной или слабокислой среде, т.к. избыток гидроксида натрия приводит к образованию гидроксида железа (III), маскирующего цвет комплекса.
Тиопентал-натрия: кроме общих реакций на барбитураты дает свои специфические реакции, обусловленные наличием серы в молекуле: так при кипячении препарата с раствором щелочи и раствором ацетата свинца выпадает темный осадок:
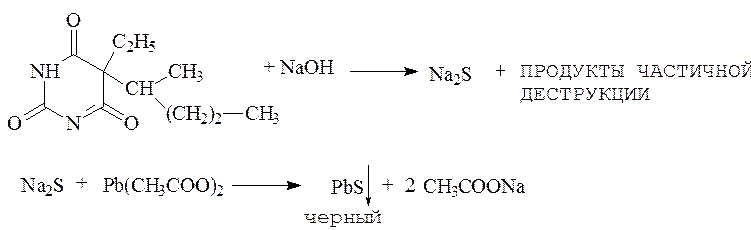
При подкислении конц. соляной кислотой выделяется сероводород, обнаруживаемый по запаху и потемнению фильтровальной бумаги, смоченной раствором ацетата свинца:
PbS + 2HCl = H2S + PbCl2
Серу можно определить и путем сухого окисления препарата. При сжигании небольшого количества препарата с карбонатом натрия и селитрой органическая часть молекулы сгорает, а сера переходит в ионогенное состояние Na2SO4, дающее осадок с хлоридом бария:
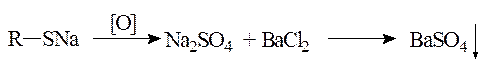
Чистота: в анализе чистоты кислотных форм барбитуратов регламентируется примесь монозамещенных производных барбитуровой кислоты (например в фенобарбитале – примесь фенилбарбитуровой кислоты). Определение проводят по изменению окраски индикатора метилового красного (рН = 4,2-6,3), т.к. кислотные свойства примеси выражены сильнее, чем лекарственного вещества.
В натриевых солях барбитуратов определяется свободная щелочь количественно в спиртовой среде титрованием соляной кислотой по индикатору тимолфталеину. Содержание ее допускается только в определенных пределах.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.