Н2SO4
г) Конденсация кетонов: СН3-СО-СН3
→ 1,3,5-триметилбензол д) Дегидрирование циклоалканов: 
 Pd, 300°С
Pd, 300°С
—→ С6Н6 + 3Н2
е) Реакция Вюрца-Фиттинга (1864):
2Na
С6Н5-Br + C2H5- Br → С6Н5-C2H5 + NaBr
з) Алкилирование по Фриделю-Крафтсу (1877):
AlCl3
С6Н6 + С2Н5-Cl → С6Н6-С2Н5 + HCl
Н2SO4
C6H6 + CH2=CH2 → С6Н6-С2Н5
и) Восстановление ароматических кетонов по Клеменсену (1913):
Zn/Hg, HCl
С6Н5-С=О → С6Н5-СН2-СН2-СН3
| пропилбензол
СН2-СН3
этилфенилкетон
В резельтате реакции получаются алкиларены с нормальной боковой цепью.
4. Современные представления о строении бензола.
Структурную формулу бензола – циклогексатриена с чередующимися двойными связями, отвечающего составу СnH2n-6 , впервые предложил немецкий химик А.Кекуле в 1865г. Но эта формула не полностью описывает химические свойства бензола, в частности не объясняет его химическую особенность в реакциях электрофильного присоединения и реакциях окисления.
С помощью рентгеноструктурного анализа кристаллического бензола и метода дифракции электронов было установлено, что молекула бензола представляет собой правильный плоский шестиугольник: все атомы углерода и водорода лежат в одной плоскости, валентный угол составляет 120°, все связи равноценны, длина связей С-С = 0,139нм, С-Н = 0,109нм. Таким образом геометрия молекул бензола указывает на то, что атом углерода находится в sp2-гибридном состоянии. каждый атом углерода образует 3 сигма связи (2 – с С и 1-с Н). У каждого атома углерода осталось еще по 1 электрону, который находится на р-орбитали, перпендикулярной плоскости молекулы:
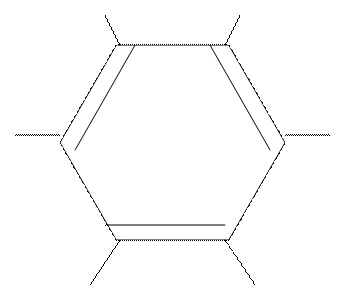
В молекуле бензола имеется П-П сопряженная система, оси р-облаков параллельны (С=С = 0,133нм, С-С = 0,154нм).
Таким образом молекула бензола стабилизирована за счет возникновения делокализованных связей (делокализация связи – распределение валентной электронной пары по нескольким связям).
Бензол является сильно ненасыщенным соединением. Но, несмотря на высокую ненасыщенность, он по химическим свойствам резко отличается от нерпедельных соединений.
1 особенность – повышенная стабильность бензольного кольца. Бензол:
а) не претерпевает никаких изменений при нагревании до 900°С;
б) не окисляется обычными окислителями;
в) не дает качественных реакций на непредельный характер (не обесцвечивает бромную воду и реактив Вагнера);
г) не присоединяет минеральных кислот;
д) не склонен к реакциям полимеризации.
2 особенность – для бензола типичны реакции замещения, так как в результате этих реакций сохраняется устойчивая система бензольного кольца. Бензол – источник П-электронов, т.е. может подвергаться атакетольке электрофилов, следовательно для него характерны реакции электрофильного замещения.
Вся совокупность перечисленных свойств называется ароматичностью – это склонность вещества при явной ненасыщенности проявлять свойства предельных соединений.
ХИМИЧЕСКИЕ СВОЙСТВА
I. Реакции, обнаруживающие непредельный характер бензола.
Для таких реакций, нарушающих термодинамически стабильный замкнутый секстет Пи-электронов, необходимы жесткие условия (высокая температура, облучение). Особенность этих реакций – присоединение сразу трех моль реагента.
1) Гидроборирование (Ni,180°С): С6Н6 + 3Н2 → С6Н12
2) Галогениерование (свет): С6Н6 + 3Cl2 (Br2)→ С6Н6Cl6
гексахлорциклогексан
(гексахлоран)
3) Озонирование: С6Н6 + 3О3, Н2О → 3 НОС-СНО
глиоксаль (через взрывчатое вещество – триозонид)
4) Окисление бензола (устойчив к действию перманганата калия, азотной кислоты, дихромата калия) (V2O5 ,450°С):
С6Н6 + О2 → НООС-СН=СН-СООН + 2Н2О + 2СО2
малеиновая кислота
5) Полное окисление до СО2 и Н2О.
II. Реакции электрофильного замещения:
FeBr3
![]() C6H5 –H + Br2 1C6H5
–Br + HBr галогенирование
C6H5 –H + Br2 1C6H5
–Br + HBr галогенирование
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.