2.Можно осуществлять получение полимера с заданным пространственным строением макромолекул, следовательно и желаемыми свойствами.
Полимеризация алкадиенов
Образуются каучукоподобные полимеры (СК). Полимеризация может иметь ионный или цепной механизм, катализатор соответственно – щелочные металлы, металлоорганические соединения или неорганические пероксиды.
Особенности:
- у алкадиенов возможны два типа полимеризации, протекающих по схеме 1,2- или1,4- присоединения:
- на каждое звено молекулы мономера в каучуке приходится одна двойная связь;
- при 1,4-полимеризации возможно образование цис- и транс- конфигурациикаждого мономерного звена:
Полимеризация алкинов.
1)Линейная полимеризация алкинов.
2)Линейная полимеризация ацетилена.
3)Линейная ди- и тримеризация ацетилена.
4)Циклическая олигомеризация алкинов.
ЦИКЛОАЛКАНЫ
Циклоалканы – углеводороды, в цикл которых входят только атомы углерода. Эти соединения широко распространены в природе: входят в состав нефти, содержатся в стероидных гормонах, душистых веществах, витаминах, природных инсектицидах.
Из этих циклов наибольшее значение имеют соединения с шестью атомами в кольце.
Алициклические соединения включают:
1)циклические УВ и их производные;
2)терпеноиды, каротиноиды;
3)стероиды.
Циклические УВ-ные производные:
1) предельные циклические УВ – циклоалканы СnH2n
2) непредельные – циклоалкены циклоалканы СnH2n-4
1. Номенклатура и изомерия
Простейший циклический УВ – С3Н6:
![]()
![]()

![]()
Для УВ состава С5Н10 возможны пять изомеров.
![]()
 Непредельные циклические УВ:
Непредельные циклические УВ: 
циклобутен
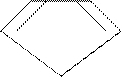
циклопентадиен-1,3
2. Получение.
Общие методы.
1. Дегалогенирование дигалогенпроизводных металлическим натрием(Фрейнд) или цинком (Густавсон):
Zn
Cl-CH2-CH2-CH2-Cl → циклопропан + ZnCl2
4-,5-,6-тичленные циклы таким образом образуются с трудом.
2. Циклизация алифатических дикарбоновых кислот путем:
а) их нагревания с оксидами некоторых металлов (МnО, ВаО);
б) перегонки кальциевых солей. Удобно для синтеза 5-, 6-членных циклов:
![]() СН2-СН2-СООН МеО
СН2-СН2-СО СН2-СН2-СН2
СН2-СН2-СООН МеО
СН2-СН2-СО СН2-СН2-СН2
![]() | —→
| О → | |
| —→
| О → | |
СН2-СН2-СООН -Н2О СН2-СН2-СО -СО2 СН2-СН2-СН2
![]() адипиновая кислота
адипиновая кислота![]()
3.Конденсация дигалогенпроизводных УВ натриймалоновым эфиром (для синтеза 4-,5-,6-тичленных циклов):
СН2-Вr H2C-CH2
| NaCH-(COOC2H5) ,2H2O | |
СН2 ————→ H2C-CH-COOH
| -NaBr циклобутановая кислота
СН2-Вr
Специальные методы получения
1.Получение циклопропанов:
дегалогенирование или дезацилирование ß-замещенных соединений, содержащих электрофильные группы (-С=О, -СООН, -NO2):
Н
| —
У—СН2— СН2— СН2—X → У—СН— СН2— СН2—X →
![]()
Х-Br, Cl
У-СOR, COOR, C=N, NO2
2.Получение циклобутанов: циклодимеризация непредельных соединений. Но! невозможно димеризовать этилен в циклобутан.
Синтез по С.В.Лебедеву, 1911г.:
—→СН2 СН21,2-диметиленциклобутан
СН21,2-диметиленциклобутан
| ж/ф, 110-115º
СН2=С=СН2 —→
аллен | 400º СН2
→ СН2![]() (~ 85%)
(~ 85%)
3.Получение циклопентанов (синтезируют общими методами).
4.Получение циклогексанов. Реакция диенового синтеза (О.Дильс и К.Альдер, 1928г.). Реакция заключается во взаимодействии соединений, содержащих сопряженную систему двойных связей с соединениями, имеющими двойные или тройные связи, активированную ЭА-группами.
СН=О
СН2=СН-СН=СН2
+ СН2=СН-СНО → 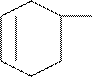
диен диенофил
Циклогексанон и циклогексанол синтезируют каталитическим гидрированием фенола и окислением циклогексана:
Н2,180°С [О] [О]
фенол → циклогексанол → циклогексанон — циклогексан
3.Строение циклоалканов.
Теория напряжения Байера.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.