А.Байер (1885г.) предложил теорию, применимую к 3,4- и 5-тичленным циклам. Согласно данной теории в тех циклических соединениях, в которых направление валентных связей отклоняется от тетраэдрического угла (109°28'), возникают напряжения, причем они будут тем значительнее, чем болше отклонение, которое определяется значением угла, вычисляемым как половина разности между 109°28' , и значением внутреннего угла правильного многоугольника. Например, для 3-хчленного цикла этот угол будет равен:
(109°28'-60°)/2 = +24°44'
Следовательно, по Байеру напряжения в цикле снижаются от 3-членного (наиболее напряженного) к пятичленному, а затем вновь возрастают (при условии плоского строения цикла). Но в действительности этого нет – макроциклические соединения химически относительно инертны, в особенности к реакциям присоединения.
Исследования показывают, что начиная с циклогексана углеводороды имеют неплоское строение, их валентные углы не отклоняются от тетраэдрического и в них отсутствует байеровское напряжение. Относительный запас энергии 3-членного цикла будет наибольшим (наибольшая теплота сгорания), а 6-тичленного - наименьшим.
Для объяснения устойчивости циклогексана было высказано предположение, что они имеют неплоское строение, при котором в циклогексане 4 атома углерода расположены в одной плоскости, а два атома - в другой (Х.Закс и Е.Мор).
В обычных условиях циклогексан находится в форме «кресла» (атомы водорода не создают взаимных пространственных затруднений), которые на 29,3 кДж устойчивее формы «ванны». Существует третья конформация, свободная от углового напряжения – «твист», ее энергия на 5,44 кДж ниже энергии «ванны» вследствие уменьшения отталкивания между водородами в положениях 1,4-.
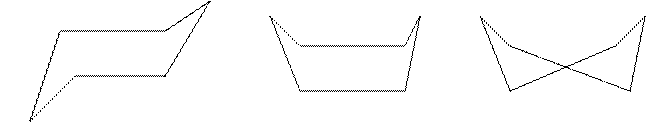
«кресла» - 1 «ванны» - 2 «твист» - 3
Равновесие между конформациями 1 и 3 существует, хотя и незначительное.
В форме «кресло» различают 2 типа связей между атомами водорода и углерода: аксиальные и экваториальные. Аксиальные попеременно направлены в противоположные стороны от плоскости кольца; экваториальные направлены радиально от плоскости кольца и попеременно отклонены вверх и вниз. В производных циклогексана различное положение заместителей оказывает влияние на их химические свойства.
4.Химические свойства.
Химические превращения протекают по трем направлениям:
1. замещение водородных атомов при атоме углерода;
2. раскрытие кольца;
3. превращение кольца: сужение, расширение.
Склонность к превращениям зависит от прочности кольца (наименее – в циклобутане и циклопропане).
а) Каталитический гидрогенолиз (присоединение водорода с разрывом С-С связи). Катализаторы - Pt, Ni на различных носителях, 25°С.

 → С3Н8
→ С3Н8
Для алкил циклопропанов в зависимости от катализатора реакцию можно проводить по двум направлениям:
1) разрыв С-С связи между наиболее гидрогенизированными атомами углерода (Pt);
2) сначала изомеризация в алкены с разрывом связей, примыкающих к наименее гидрогенизированному атому углерода кольца, а затем гидрирование алкенов (силикагель, алюмосиликаты):
СН3 1)
 І
І→ СН3-СН(СН3)-СН3
І
І→ СН3-СН(СН3)-СН3
— Н2
І→ СН2=СН-СН2-СН3 →С4Н10
2)СН3-СН=СН-СН3
Для алкилциклобутанов легкость разрыва всех С-С связей кольца приблизительно одинакова. Гидрогенолиз циклопентанов был изучен Б.А.казанским:
→ н-циклогексан (12%)
|
метилциклопентан — → 2-метилпентан (66%)
|
→ 3-метилпентан(22%)
Трудность разрыва связей возрастает в положении: 2-3 (4-5), 3-4, 1-2(1-5).
Скорость гидрирования снижается в ряду: ц-С3>ц-С4>ц-С5.
Циклогексан устойчив к гидрированию.
б) Галогенирование. В обычных условиях бром не реагирует с циклопропаном, но кислород и свет инициируют цепную радикальную реакцию присоединения с раскрытием кольца. Хлор в отличие от брома и йода преимущественно замещает атом водорода и образует 1,1-дихлорциклопропан:
Br2, свет
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.