ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
НОВОСИБИРСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
ПО ФИЗИЧЕСКОЙ ХИМИИ
Методическое пособие
Новосибирск
2007
Методическое пособие содержит описание лабораторных работ, выполняемых в практикуме по химической термодинамике. В пособии изложены основные принципы потенциометрии в объёме, достаточном для выполнения предлагаемых работ.
Предназначено для студентов 3-го курса факультета естественных наук Новосибирского государственного университета.
Составители
канд. хим. наук В. А. Рогов,
д-р хим. наук А. Г. Степанов,
д-р хим. наук Г. А. Коваленко
Рецензент
канд. хим. наук К. П. Брыляков
© Новосибирский государственный
университет, 2007
Введение
Потенциометрия – это электрохимический метод определения различных физико-химических величин, основанный на измерении равновесного электродного потенциала индикаторного электрода, погружённого в исследуемый раствор. Потенциал индикаторного электрода, определяющийся активностью компонентов электрохимической реакции, измеряется по отношению к электроду сравнения. Потенциометрию широко применяют в аналитической химии для определения концентрации веществ в растворах (потенциометрическое титрование), для измерения концентрации ионов водорода (рН-метрия), а также других ионов (ионометрия).
В методическом пособии даётся описание основных понятий, уравнений и устройств, используемых в потенциометрии. В силу краткости изложения оно является несколько упрощённым, а делаемые утверждения в некоторых случаях верны только в ограниченной области изменения параметров. Тем не менее, данное пособие даёт первоначальное представление об основных принципах потенциометрии, достаточное для выполнения предлагаемых лабораторных работ и для сознательного обращения с имеющимся оборудованием. Более расширенное и точное понимание предмета и метода потенциометрии и её приложений требует знакомства со специальной литературой, ссылки на которую даны в конце пособия [1–5]. Рекомендуется также прочесть нескольких полезных статей, написанных живым и понятным языком и опубликованных в Соросовском образовательном журнале [6–9].
Что такое гальванический электрод?
Исторически первыми рукотворными устройствами, составленными из двух электродов, были гальванические элементы, т. е. химические источники тока, вырабатывающие электрическую энергию за счёт прямого преобразования химической энергии окислительно-восстановительных реакций. Их использование, возможно, началось гораздо раньше, чем принято считать. В раскопках шумерских поселений, относящихся к третьему тысячелетию до нашей эры, археологи нашли предметы, которые могли функционировать как электрохимические устройства. Это были глиняные и терракотовые горшки с асфальтовой пробкой, через которую пропущены железный и медный стержни. Когда в них залили морскую воду – доступный в те времена электролит, – оказалось, что они вполне сохранили способность вырабатывать электрический ток [6]. Недавно (в 2000 г.) было отмечено 200-летие «Вольтова столба», который, по мнению французского физика Д. Араго, представляет «снаряд, чуднее которого не изобретал человек, не исключая даже телескопа и паровой машины». В этом устройстве два металла (медь и цинк) разделялись картоном или кожей, смоченными соленой водой.
Рассмотрим в качестве примера элемент Даниэльса – Якоби (1836 г). В этом элементе один электрод представляет собой медную пластинку, находящуюся в растворе сульфата меди, а другой электрод – цинковую пластинку в растворе сульфата цинка. Растворы имеют между собой жидкостное соединение через солевой мостик или электролитический ключ, представляющий собой стеклянную трубку, заполненную насыщенным раствором KCl (рис. 1).
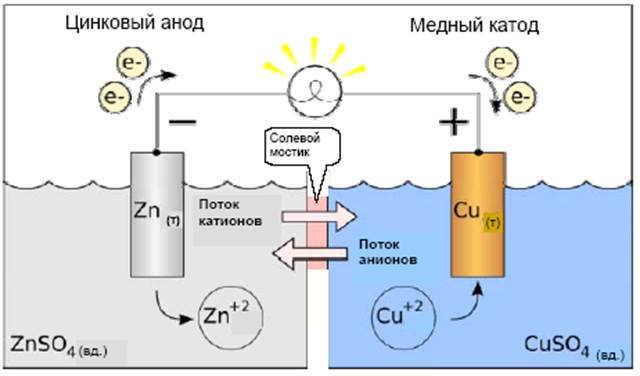
Рис. 1. Гальванический элемент Даниэльса – Якоби
Важно заметить, что электрод – это не одна только металлическая пластинка, а металлическая пластинка с окружающим её раствором электролита, содержащим ионы, которые участвуют в окислительно-восстановительной реакции. Металлические части электродов при работе элемента Даниэльса – Якоби выполняют двоякую функцию: они являются реагентами в электродных реакциях окисления и восстановления, но одновременно они играют роль своеобразной «банки с электронами», которые являются участниками электрохимического процесса. Электродная реакция на катоде – это реакция восстановления (М2+ + 2е– = M), в гальваническом элементе катод заряжен положительно. Для протекания этой реакции используются электроны из металлической пластинки, которая является донором электронов. Электродная реакция на аноде – это реакция окисления (М = М2+ + 2е–), в гальваническом элементе анод заряжен отрицательно. Для протекания реакции окисления нужен акцептор электронов, которым также служит металлическая пластинка. В элементе Даниэльса – Якоби медный электрод является катодом, а цинковый электрод – анодом.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.