В ходе титрования слабой кислоты сильной щёлочью достаточно быстро начинает выполняться условие b>> |[OH–] – [H+]|. Поэтому при титровании [A–] »b. Учитывая уравнение материального баланса
![]() ,
,
получаем
![]() ,
,
и выражение для константы диссоциации сводится к следующему:
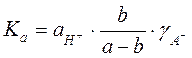 .
.
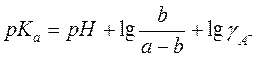 .
.
Величину коэффициента активности можно вычислить по теории Дебая–Хюккеля. Если ограничиться вторым приближением теории, получаем следующую формулу для расчёта pKA:
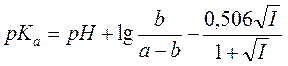 . (11)
. (11)
При обработке результатов по этой формуле следует построить зависимость рассчитанной величины pKA от I и ограничиться областью, где ионная сила раствора невелика и pKA примерно постоянна.
Экспериментальная часть
Экспериментальная установка состоит из рН-метра «Анион 4101», который работает в режиме измерения рН, и гальванической
|
Рис. 12. Комбинированный электрод и датчик температуры |
ячейки. Ячейка представляет собой стаканчик на 50 мл, в который опущен комбинированный электрод ЭСК-10601/7, включающий в себя стеклянный электрод и хлорсеребряный электрод сравнения. Кроме электродов, в стаканчик опущен также датчик температуры (на рис. 10 он чёрный, слева от электрода). Измерения проводятся при комнатной температуре. Перед началом измерений нужно ознакомиться с порядком работы на рН-метре по инструкции, находящейся на рабочем столе. |
Приготовление растворов
Исходные водные растворы приготовлены лаборантом и имеют следующие концентрации:
|
Растворенное вещество |
Концентрация |
|
Муравьиная кислота, или уксусная кислота |
» 0,1 М (точное значение измеряется при выполнении работы) |
|
KOH |
» 0,1 М (точное значение написано на ёмкости с раствором) |
Проведение измерений
Приподнять держатель, в котором закреплены комбинированный электрод и датчик температуры, убрать стаканчик с раствором, в котором они находились, и обмыть дистиллированной водой. Налить 40 мл раствора кислоты в стаканчик на 100 мл, поместить туда якорёк и поставить на магнитную мешалку. Опустить в стаканчик комбинированный электрод и датчик температуры, измерить pH раствора, результат записать.
Оттитровать этот раствор щелочью для предварительного определения точки эквивалентности.
Провести повторное титрование, добавляя вначале по 1
мл щелочи, а вблизи точки эквивалентности – по 0,1 мл. Построить
дифференциальный график ![]() от V (V
– объём прилитой щелочи), найти точку эквивалентности и рассчитать точную
концентрацию кислоты.
от V (V
– объём прилитой щелочи), найти точку эквивалентности и рассчитать точную
концентрацию кислоты.
Результаты экспериментов занести в таблицу.
Рассчитать константу диссоциации кислоты и pKa по измеренному значению pH рабочего раствора HA(первый способ).
Перестроить кривую титрования, пользуясь формулой (11). Найти pKa исследуемой кислоты, используя область с небольшой ионной силой, где рассчитанное значение pKa примерно постоянно (второй способ).
Задача П-3
ИЗМЕРЕНИЕ ТЕМПЕРАТУРНОГО КОЭФФИЦИЕНТА ЭДС ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА И РАСЧЁТ ТЕРМОДИНАМИЧЕСКИХ ВЕЛИЧИН
Целью работы является измерение температурного коэффициента гальванического элемента и расчёт изменения энергии Гиббса и энтропии при протекании химической реакции в гальваническом элементе. Исследуется процесс в элементе, составленном из водородного и хлорсеребряного электродов с HCl в качестве электролита.
В разделе «Термодинамика гальванического элемента» показано, что существует простое соотношение (3), связывающее ЭДС гальванического элемента E и изменение энергии Гиббса в ходе реакции:
![]() .
.
Дифференцируя это соотношение по температуре, получаем выражение для изменения энтропии в ходе реакции:
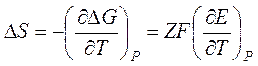 .
.
В работе используется гальванический элемент, составленный из водородного и хлорсеребряного электродов с HCl в качестве электролита:
![]() .
.
В элементе протекает реакция
1/2 H2 + AgCl = HCl + Ag.
Потенциал левого (водородного) электрода равен
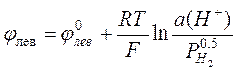 .
.
Если давление водорода равно 1 атм, то
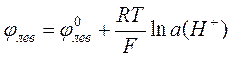 .
.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.