– ЭДС элемента равна разности электродных потенциалов катода (справа) и анода (слева) Е = jправ – jлев.
– Стандартные электродные потенциалы, приведенные в справочниках и в прил. 4, даны для электродных реакций, записанных как реакции восстановления. Стандартный потенциал электрода равен разности электродных потенциалов элемента, в котором исследуемый электрод является правым, а нормальный водородный электрод – левым. Он определяется в условиях, когда активности ионов и летучести газов, участвующих в электродной реакции, равны единице.
Основные типы электродов. Наиболее распространённые электроды
Электрод первого рода представляет собой металл, опущенный в раствор, содержащий ионы этого же металла. Если такой электрод в гальваническом элементе является анодом, то металл при протекании реакции окисляется и растворяется, если катодом – то восстанавливается из раствора. Примерами электродов первого рода являются электроды, из которых составлен элемент Даниэльса – Якоби.
Серебряный электрод Ag+|Ag, в котором протекает реакция
![]() ,
,
также является электродом первого рода. Потенциал этого электрода равен
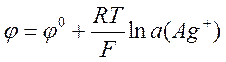 .
(6)
.
(6)
Электрод второго рода состоит из металла, покрытого слоем труднорастворимого соединения этого металла и опущенного в раствор соли, содержащей тот же анион, что и в используемом трудно-растворимом соединении металла. Потенциал электрода второго рода зависит от концентрации аниона, не участвующего в окислительно-восстановительной реакции.
Примерами электродов второго рода являются хлорсеребряный и каломельный электроды.
Хлорсеребряный электрод Cl–,AgCl|Ag – это то, во что превращается серебряный электрод Ag+|Ag, если поверхность серебра покрыть слоем AgCl, а в раствор добавить электролит, содержащий хлорид-ионы[1]. Поскольку ионы Cl– не участвуют в электродной реакции, то потенциал электрода в соответствии с уравнением Нернста не должен зависеть от их концентрации, а будет определяться концентрацией ионов серебра. Это верно, но с оговоркой: сама эта концентрация в данном случае задаётся концентрацией хлорид-ионов, поэтому изменение концентрации последних всё-таки влияет на электродный потенциал. Действительно, учитывая произведение растворимости
L(AgCl) = [a(Ag+)]×[a(Cl–)],
можно переписать выражение (7), как
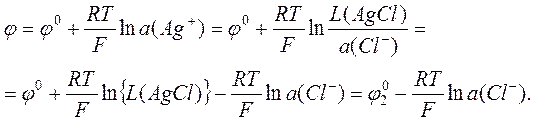 (8)
(8)
Здесь j0 – стандартный электродный потенциал серебряного электрода первого рода, а j20 – стандартный электродный потен-циал хлорсеребряного электрода второго рода. Видно, что величина концентрации хлорид-ионов однозначно определяет потенциал хлорсеребряного электрода. Полуреакция для хлорсеребряного электрода может быть записана как
![]() .
.
Хлорсеребряный электрод обладает постоянным и хорошо воспроизводимым потенциалом. В электрохимических ячейках он широко используется в качестве электрода сравнения.
Каломельный электрод Cl–,Hg2Cl2|Hg представляет собой каплю ртути, поверхность которой полностью покрыта каломелью (закисной хлористой ртутью), электролитом является насыщенный раствор KCl или раствор с концентрацией от 1,0 до 3,8 М. Электродная реакция для такого электрода записывается следующим образом:
1/2![]() .
.
Электроды на основе инертных
благородных металлов (Pt, Au, Pd, Ir).
Потенциал этих электродов определяется только окислительно-восстановительными
свойствами среды, и не зависит от материала электрода. Примером является
водородный электрод Pt, H2|H+, изображённый на рис. 2, в котором протекает
реакция ![]() .
Он представляет собой пластинку из платинированной платины, погруженную в
электролит, через который пропускают водород со скоростью 2–3 пузырька в
секунду. Потенциал водородного электрода равен
.
Он представляет собой пластинку из платинированной платины, погруженную в
электролит, через который пропускают водород со скоростью 2–3 пузырька в
секунду. Потенциал водородного электрода равен
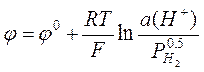 . (7)
. (7)
|
Рис. 2. Водородный электрод |
Если давление водорода равно 1 атм и активность ионов водорода в растворе равна 1 моль/л, то водородный электрод называется нормальным водородным электродом (НВЭ). Стандартный электродный потенциал НВЭ равен нулю при любой температуре. Водородный электрод можно использовать в широком диапазоне температур и рН. Он может работать в щелочных растворах до концентрации 4 М, в растворах серной кислоты – до 17 М. К недостаткам водородного электрода следует отнести высокие требования к чистоте водорода и электролита. |
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.