Объединение электродов в измерительную ячейку
Измерительная ячейка, как и гальванический элемент, состоит из двух электродов, соединённых друг с другом. Поскольку состав электролита в левом и правом полуэлементах различен, разработаны специальные способы их соединения. Существуют элементы с жидкостными соединениями и элементы без жидкостных соединений.
Один из возможных способов жидкостного соединения электродов уже упоминался выше: это использование солевого мостика. Солевой мостик представляет собой стеклянную трубочку, заполненную очень вязким гелеобразным раствором хлорида калия, например, насыщенный раствор KCl в агар-агаре. Выбор хлорида калия в качестве электролита для заполнения солевого мостика определяется тем, что подвижность ионов и числа переноса K+ и Cl– примерно одинаковы [10] ввиду близости их размеров и масс. Поэтому при протекании электрического тока через солевой мостик, заполненный раствором KCl, на его границах не возникает так называемый диффузионный потенциал.
Возникновение диффузионного потенциала при протекании электрического тока через электролит связано с тем, что перенос зарядов осуществляется катионами и анионами не в одинаковой степени. Поэтому при протекании тока через электролит, заполняющий солевой мостик, в котором анионы и катионы обладают разной подвижностью, на границах раздела с жидкими фазами, которые он соединяет, появляется дополнительная разность потенциалов. Если мостик заполнен раствором хлорида калия, этот эффект минимален, потому что подвижности обоих ионов примерно одинаковы и токи, определяемые диффузией анионов и катионов через жидкостное соединение, равны по величине. Такое соединение называют равнопроводящим. Кроме хлорида калия для заполнения солевого мостика можно использовать растворы KNO3, NH4NO3, RbCl.
Иногда можно использовать один и тот же электролит в каждом из электродов. Электрохимические ячейки, в которых оба электрода погружаются в один общий электролит, называются ячейками без переноса. Например, в элементе, составленном из водородного электрода и хлорсеребряного электрода, в качестве электролита можно взять раствор HCl, общий для обоих электродов. При этом никакого дополнительного соединения не требуется.
Измерение ЭДС элемента
Для измерения ЭДС гальванического элемента, т. е. разности электродных потенциалов, взятой со знаком плюс, в принципе достаточно использовать обычный вольтметр. Однако чтобы полученное значение соответствовало равновесным условиям, необходимо, чтобы значение тока в измерительной цепи было минимальным. Для этого можно применять компенсационные схемы или использовать вольтметр с большим входным сопротивлением (десятки или сотни Мом). Последнему условию удовлетворяют электрические схемы рН-метров и иономеров, и в этих приборах обычно предусмотрена функция измерения ЭДС.
Измерение рН
Важнейшей задачей потенциометрии является измерение рН водных растворов. Ясно, что для этой цели в принципе подходит любой электрод, потенциал которого зависит от концентрации (активности) ионов водорода. Можно использовать, например, водородный электрод, описанный выше. В качестве электрода сравнения (левого электрода) можно использовать НВЭ. Если водород подаётся под давлением 1 атм, то потенциалы электрода сравнения и измерительного электрода равны, соответственно
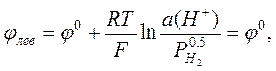
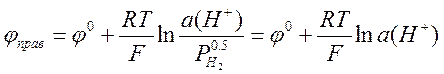 ,
,
а разность электродных потенциалов гальванического элемента равна
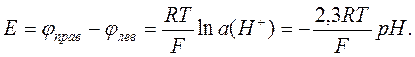
Достоинством такого метода определения рН является отсутствие необходимости калибровки, так как измерение даёт абсолютный результат. Однако для рутинных измерений рН водородный электрод неудобен, поскольку требуется источник газообразного водорода (баллон или генератор).
В рН-метрах промышленного производства обычно используют так называемые стеклянные электроды. Стеклянный электрод не является гальваническим электродом, т. е. не относится к группе электродов, которые мы описывали до этого. Механизм возникновения электродного потенциала у стеклянного электрода связан не с окислительно-восстановительной реакцией, а с мембранными процессами, напоминающими, в известной степени, осмотические явления.[2]
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.