|
m, моль/кг |
E, В |
0,222–E, В |
(0,222–E) /0,0591 |
(mg±)2 |
mg± |
g± |
|
0,001 |
0,5784 |
–0,3564 |
–6,0310 |
9,31E–07 |
0,000965 |
0,965 |
|
1 |
0,2329 |
–0,0109 |
–0,1841 |
0,654481 |
0,809 |
0,809 |
Можно не использовать справочное значение j0, а извлечь его из полученных данных. Однако в таком случае
уравнение Нернста содержит две неизвестных величины: константу j0 и переменную g±, которая является функцией концентрации.
В качестве второго уравнения можно взять формулу Дебая–Хюккеля. Чтобы охватить весь массив
полученных данных, следует применять третье прибли-жение теории Дебая–Хюккеля. Следует учесть, что для раствора HCl
ионная сила I совпадает с концентрацией m, а ![]() :
:
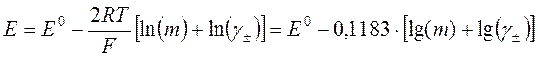 .
.
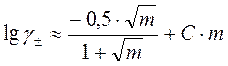 .
.
Если исключить из этих уравнений g±, получаем
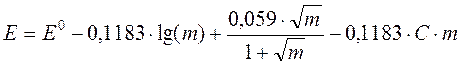 .
.
Полученное уравнение тоже содержит две неизвестные величины: стандартную разность электродных потенциалов элемента E0 и коэффициент третьего приближения С. Но поскольку обе они являются константами, удаётся построить линейную анаморфозу, из которой можно определить E0. Для этого перегруппируем слагаемые
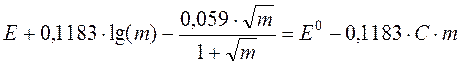 .
.
Обозначая правую часть равенства символом E¢, имеем
![]() .
.
Последнее выражение есть искомая линейная анаморфоза. Нужно построить график зависимости E¢ от mи определить E0 из отрезка, отсекаемого на оси y. Величина E¢комбинируется из экспериментально измеренных значений ЭДС элемента при разных m и двух слагаемых, зависящих только от m. После определения E0 следует повторить описанную выше процедуру определения среднеионного коэффициента активности.
Экспериментальная часть
Экспериментальная установка состоит из гальванической ячейки, составленной из водородного и хлорсеребряного электродов, генератора водорода для питания водородного электрода, термостата и рН-метра, который работает в режиме измерения ЭДС (рис. 11).
Измерения проводятся при температуре 25 0С, термостат включается лаборантом. Студентам следует ознакомиться с инструкцией по работе с термостатом и периодически контролировать темпе-
|
|
|
Рис. 11. Гальваническая ячейка, используемая в работе П-1 (слева) и водородный электрод, входящий в состав ячейки (справа). Водород поступает по трубке и пробулькивает около платиновой пластинки
ратуру. Генератор водорода заранее включается лаборантом, студентам следует ознакомиться с его устройством по описанию.
Приготовление растворов
В работе используются следующие растворы:
– исходные готовые растворы HCl, приготовленные лаборантом, их концентрации указаны на ёмкостях с растворами;
– рабочие растворы.
Из исходных готовых растворов HCl студенты готовят следующие рабочие растворы в мерных колбах на 200 мл (доводят до метки водой): 0,001; 0,005; 0,01; 0,05; 0,1; 0,5; 1,0 N.
Проведение измерений
Заполнить ячейку исследуемым раствором, установить её в термостат и пропустить ток водорода в водородный электрод.
Измерить последовательно ЭДС элементов, заполненных растворами соляной кислоты, начиная с меньших концентраций. Следует иметь в виду, что равновесная ЭДС устанавливается через некоторое время, необходимое для насыщения водородом платинированного платинового электрода и установления постоянной температуры. Измерение можно считать законченным, когда ЭДС ячейки меняется неболее чем на 1–2 мВ в течение 5 мин.
После окончания измерений вымыть ячейку и заполнить её дистиллированной водой.
Результаты экспериментов занести в табл. 3.
Таблица 3
Определение E0
|
CHCl, моль/л |
mHCl, моль/кг |
E, В |
E', В |
Далее следует построить зависимость E' от m и определить величину E0. Пользуясь найденной величиной E0, рассчитать коэффициенты активности растворов соляной кислоты. Данные представить в виде табл. 4.
Таблица 4
Определение ![]()
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.