|
Стеклянный электрод |
|
Электрод сравнения |
Рис. 6. Устройство ячейки для измерения рН, составленной из
стеклянного электрода и электрода сравнения
На рис. 6 схематически изображена измерительная ячейка для измерения рН с помощью стеклянного электрода.
В рН-метрах промышленного производства стеклянный электрод часто поставляется в едином блоке с электродом сравнения. Такая конструкция называется комбинированным электродом.
Комбинированный электрод, включающий вспомогательный внутренний электрод, стеклянную мембрану и встроенный электрод сравнения, может выглядеть так, как показано на рис. 7. Подробнее о стеклянных электродах можно прочесть в статье [8].
|
|
Заливочное отверстие электрода сравнения Раствор электролита в электроде сравнения Вспомогательный электрод Встроенный электрод сравнения Электролитический ключ Стандартный раствор HCl Стеклянная мембрана |
Рис. 7. Стеклянный электрод со встроенным электродом сравнения (комбинированный электрод)
В заключение этого раздела приведём схему классификации электродов (рис. 8), включающую как гальванические электроды с электрохимической реакцией, так и электроды без неё [8].
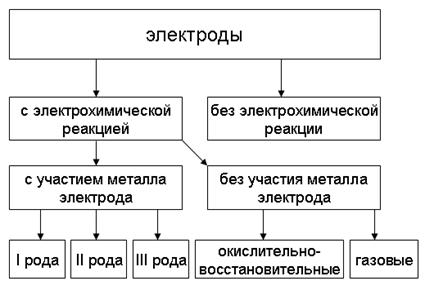
Рис. 8. Классификация электродов
Ионометрия
Ионометрия – это способ определения концентрации ионов в жидких растворах, основанный на использовании ионоселективных электродов, основным элементом которых служат мембраны, избирательно пропускающие ионы только одного вида. Исторически первым ионоселективным электродом, получившим широкое распространение, был стеклянный электрод для измерения рН. Исследования явлений, сопровождающих работу стеклянного электрода, привели к созданию различных мембран, избирательно проницаемых только для определённых катионов или только для определённых анионов. Некоторые сведения о строении ионообменных материалов, используемых для приготовления таких мембран, приведены в статье [9].
Рассмотрим анионообменную мембрану, обладающую ионной электропроводностью для анионов Cl– и не проницаемую для других анионов и катионов. Пусть по одну сторону мембраны находится стандартный раствор, содержащий хлорид-ионы, например раствор KCl, а по другую – исследуемый раствор, содержащий ионы Cl– в неизвестной концентрации, например раствор HCl. Как и в рассмотренном случае стеклянного электрода, концентрация ионов Cl– по обе стороны мембраны будет стремиться к выравниванию, однако этому будет препятствовать возникающая разность потенциалов между правым и левым растворами. Эта разность потенциалов в состоянии равновесия может быть использована для определения концентрации определяемых ионов в исследуемом растворе (в данном случае – хлорид-ионов).
Как и при измерении рН, измерительная ячейка должна содержать два гальванических электрода. Вспомогательный электрод находится внутри мембранного электрода и погружён во внутренний стандартный раствор KCl. Внешний электрод сравнения заполняется раствором электролита, который контактирует с исследуемым раствором через капилляр или электролитический ключ (рис. 9).
|
Ион-селективный электрод |
Исследуе-мый раствор, например раствор HCl |
Внешний электрод сравнения |
||||||
|
Внутренний вспомогательный хлорсеребряный электрод |
Внутренний стандартный раствор, например раствор KCl |
Мембрана |
||||||
|
j1 |
j2 |
jх |
j3 |
|||||
Рис. 9. Схема измерительной ячейки с ион-селективным электродом для определения хлорид-ионов
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.