Для освоения метода потенциометрического титрования желательно провести пробное титрование стандартного 0,01 N раствора KCl. Для этого в стаканчик на 50 мл налить 5 мл стандартного раствора KCl, добавить 15–20 мл дистиллированной воды и титровать 0,02 N раствором АgNО3, вводя его по каплям. При этом необходимо записывать объём прибавляемого раствора АgNО3 и значения ЭДС измеренные по рН-метру-иономеру.
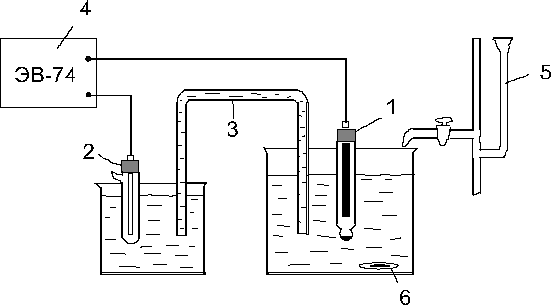
Рис. 13. Установка для потенциометрического титрования
Приготовление растворов
В работе используется два исходных раствора: раствор 0,025 М пикрилхлорида в этаноле, который готовят студенты, и раствор 0,5 M KF в этаноле, приготовленный лаборантом. Если хлористый пикрил плохо растворяется, необходимо нагреть колбу с раствором под горячей водой до полного растворения навески.
|
Растворённое вещество |
Концентрация |
Примечание |
|
Пикрилхлорид |
0,025 М |
концентрация пикрилхлорида в рабочем растворе 0,025 М |
|
Калий фтористый |
0,5 М |
концентрация KF в рабочем растворе 0,2 М |
Проведение измерений
Закрепить в термостате три мерных колбы: колбу № 1 объёмом 100 мл, в которой находится 40 мл раствора 0,025 М пикрилхлорида в этаноле, колбу № 2 на 50 мл с 40 мл раствора 0,2 М KF в этиловом спирте и колбу № 3 на 50 мл с 30 мл этилового спирта.
После 15-минутной выдержки в термостате при заданной температуре раствор KF из колбы № 2 перелить в реакционную колбу № 1 и довести до метки этиловым спиртом из колбы № 3, быстро перемешать, отметить время начала реакции и отобрать пипеткой с помощью груши аликвоту 10 мл. Аликвоту перенести в стаканчик на 50 мл, куда предварительно добавить 10 мл 0,2 N раствора Н2SО4, при этом реакция останавливается. Записать время выливания пробы в стаканчик. Методом потенциометрического титрования с хлорсеребряным электродом определить содержание хлорид-ионов в каждой пробе. Титрование проводят 0,02 N раствором АgNО3. В точке эквивалентности наблюдается скачок потенциала. Для надежного определения точки эквивалентности после ее прохождения оттитровать еще 8–10 точек.
Последующие 6 проб отбирают, в зависимости от заданной температуры реакции, через 7–15 мин и титруют таким же образом.
После окончания измерений следует построить кривые титрования (зависимость ЭДС ячейки от количества добавленного титранта). Кривая титрования имеет S-образный вид, в точке эквивалентности наблюдается скачкообразное изменение ЭДС ячейки, а на дифференциальной кривой – резкий максимум. По кривым титрования рассчитать изменение со временем концентрации ионов Cl–. Полученные результаты занести в таблицу.
Таблица 6
|
№ пробы |
t, мин |
AgNO3 мл |
х = [Cl–] |
a–x |
b–x |
|
Построить зависимость от времени величины
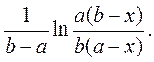
Из наклона прямой найти константу скорости, оценить точность её определения.
ПОРЯДОК РАБОТЫ С ИОНОМЕРОМ ЭВ-74
1. Включить прибор при нажатых кнопках «t», «2», и «1–19». Во всех случаях, когда измерение непосредственно не проводится, должна быть нажата кнопка «t».
2. Прогреть прибор в течение 30 минут.
3. Откалибровать температурный датчик. Для этого опустить электроды в раствор с известной температурой; нажать кнопку одного из диапазонов измерения (любую, кроме «1–19»), ручкой «температура раствора» установить стрелку по шкале 0–100 на деление, соответствующее температуре раствора, определенной по термометру.
4. После калибровки датчика температуры нажать кнопку «mV», а кнопку «t» отжать. Выбрать один из диапазонов измерения ЭДС. Первая проба титруется, используя диапазон «минус 1–4».
5. Начать титрование. Прибавлять 0,02 N раствор АgNО3 по каплям, записывать объём приливаемого раствора и значение ЭДС по прибору.
1. Что такое электрод для потенциометрических измерений? Приведите примеры электродов I и II рода.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.