Потенциал правого (хлорсеребряного) электрода –
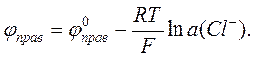
Разность электродных потенциалов элемента, составленного из этих электродов, –
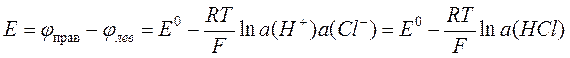 ,
,
где E0 – стандартная разность электродных потенциалов элемента. Поскольку концентрации H+ и Cl– равны, формула сводится к следующей:
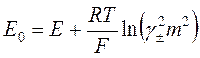 .
.
Коэффициент
активности ![]() , необходимый для расчёта
, необходимый для расчёта ![]() , рекомендуется взять из справочника [12].
, рекомендуется взять из справочника [12].
Экспериментальная часть
В данной работе используется оборудование, описанное в задаче 1. Порядок выполнения работы отличается только тем, что измерения проводятся при нескольких температурах.
Экспериментальная установка состоит из гальванической ячейки, составленной из водородного и хлорсеребряного электродов, генератора водорода для питания водородного электрода, термостата и рН-метра, который работает в режиме измерения ЭДС (рис. 11).
Измерения начинаются при температуре 25 0С, термостат включается лаборантом. Студентам следует ознакомиться с инструкцией по работе с термостатом, периодически контролировать температуру. Генератор водорода заранее включается лаборантом, студентам следует ознакомиться с его устройством по описанию.
В работе используется один готовый раствор c концентрацией HCl от 0,1 до 1,0 N (по указанию преподавателя или лаборанта).
Проведение измерений
Электрохимическую ячейку, заполненную раствором НCl, поместить в термостат, установленный на температуру 25 0С, и выдержать 10–15 мин. Измерить ЭДС с точностью не менее 1 мВ несколько раз до тех пор, пока показания рН-метра не перестанут меняться. Аналогичные измерения провести при температурах 35, 45 и 55 0С. Результаты занести в таблицу.
Таблица 5
Результаты измерений
|
СHCl моль/л |
Т,°С |
E, В |
|
|
Далее следует
построить график зависимости ![]() от температуры, определить значения производной (¶E0/¶T)P и вычислить DrG0 и DrS0.
от температуры, определить значения производной (¶E0/¶T)P и вычислить DrG0 и DrS0.
Для химической реакции, протекающей в элементе, с помощью таблиц стандартных термодинамических величин рассчитать DrG0 и DrS0. Сравнить расчетные и экспериментальные величины.
Задача К-5
ЭТАНОЛИЗ ПИКРИЛХЛОРИДА
В данной работе исследуется кинетика этанолиза пикрилхлорида и определяется константа скорости этой реакции. Метод потенциометрического титрования применяется для определения концентрации ионов Cl–, образующихся при замещении атомов хлора в молекулах хлористого пикрила на этокси-группы.
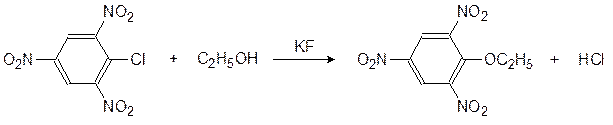
Скорость этой реакции сильно возрастает в присутствии фторидов щелочных металлов, в частности KF. Механизм действия фторидов, вероятно, связан с образованием алкокси-ионов:
![]() ¬¾®
¬¾® ![]()
Известно, что реакция имеет первый порядок по пикрилхлориду. Зависимость скорости реакции от концентрации фторида калия является нелинейной, однако при значительном избытке KF порядок реакции по фториду можно считать близким к первому. Это позволяет, в качестве первого приближения, вести расчет константы скорости по уравнению
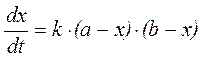 ,
,
где х – концентрация ионов Cl–, а – начальная концентрация хлористого пикрила, b – начальная концентрация фторида. Множитель (b – х) учитывает убыль фторида калия по реакции
![]() .
.
Кинетику реакции изучают путем отбора проб с последующим потенциометрическим титрованием раствором АgNО3. Реакцию проводят при температуре 35–45 0С при начальной концентрации хлористого пикрила 0,01 моль/л.
Экспериментальная часть
Установка для потенциометрического титрования показана на рис. 13. Она включает хлорсеребряный электрод (1), каломельный электрод сравнения (2), солевой мостик (3), заполненный концентрированным раствором KNО3 с агар-агаром, рН-метр-иономер ЭВ-74 (4) или Анион-4101, а также микробюретку (5) и магнитную мешалку (6). Микробюретка имеет объём 5 мл и заполнена раствором АgNО3.
При титровании изучают зависимость ЭДС ячейки от объёма приливаемого раствора АgNО3 и находят точку эквивалентности, в которой наблюдается скачок потенциала. По этим данным определяют концентрацию ионов Cl– в момент отбора пробы.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.