Принцип работы стеклянного электрода легко понять, если представить себе мембрану, обладающую селективной проводимостью (высоким значением коэффициента диффузии) для ионов водорода и разделяющую два раствора с различной концентрацией Н+. Пусть активность ионов водорода в стандартном растворе слева от мембраны равна 0,1 M, а активность (концентрация) ионов водорода в исследуемом растворе справа от мембраны ниже, чем слева. В таком случае возникнет диффузионный поток ионов Н+ через мембрану слева направо, стремящийся выровнять концентрации. Однако через некоторое время процесс остановится, поскольку между растворами возникнет разность потенциалов, противодействующая дальнейшему переносу протонов.
Эта разность потенциалов в состоянии равновесия будет однозначно связана с активностью ионов Н+ в исследуемом растворе и может быть использована для определения рН. В простейшем случае эта связь передается уравнением Доннана, совпадающим по виду с уравнением Нернста:
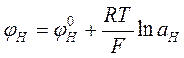 ,
,
где величина ![]() зависит только от материала мембраны, вида
электрода и температуры. Данное соотношение выполняется в ограниченном
диапазоне рН, впрочем, весьма широком. Для некоторых стеклянных электродов оно
справедливо при изменении рН в пределах от 0 до 10.
зависит только от материала мембраны, вида
электрода и температуры. Данное соотношение выполняется в ограниченном
диапазоне рН, впрочем, весьма широком. Для некоторых стеклянных электродов оно
справедливо при изменении рН в пределах от 0 до 10.
Однако прямое измерение разности потенциалов между растворами обычным вольтметром наталкивается на ту же сложность, что и попытка прямого измерения потенциала гальванического электрода. В месте контакта жидких растворов с металлическими проводами, идущими от вольтметра, возникают скачки электрического потенциала, и результат измерения становится некорректным. Необходимо найти способ, как правильно соединить измерительный прибор с электролитом. Решение состоит в том, что нужно присоединить к растворам слева и справа от мембраны по дополнительному электроду (можно использовать хлорсеребряные электроды) и подключить вольтметр к металлическим частям этих электродов. Один из этих электродов называется внутренним вспомогательным, а другой – внешним электродом сравнения (рис. 3). На схеме показан электролитический ключ, обозначенный буквой «K». В простейшем случае это капилляр, настолько тонкий, что перемешивания растворов не происходит.
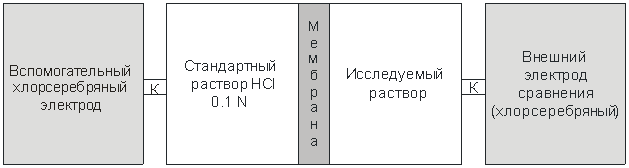
Рис. 3. Схема измерительной ячейки со стеклянным электродом для определения рН
На самом деле внутренний вспомогательный электрод погружен непосредственно в стандартный раствор 0,1 N HCl. Поэтому в ячейке присутствуют только три раствора: стандартный раствор HCl (он же является электролитом для внутреннего вспомогательного электрода), исследуемый раствор и раствор KCl во внешнем электроде сравнения.
Вспомогательный электрод, стандартный раствор HCl и мембрана образуют устройство, называемое стеклянным электродом, внешний вид которого показан на рис. 4.
мембрана стандартный вспомогательный стеклянный
раствор HCl электрод корпус
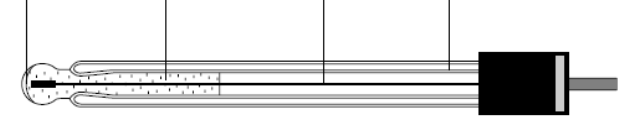
Рис. 4. Устройство стеклянного электрода
В качестве внешнего электрода сравнения используют хлор-серебряный электрод. Внутренним электролитом в нём является раствор хлорида калия, который соединяется с исследуемым раствором электролитическим ключом. Это может быть пористая керамика или тонкий капилляр (рис. 5).
|
|
отверстие для заливки раствора электролита серебряная проволочка, покрытая слоем AgCl раствор KCl капилляр |
Рис. 5. Устройство хлорсеребряного электрода сравнения
Всё было бы хорошо, если бы удалось найти соответствующую мембрану с протонной проводимостью. В действительности в конструкции стеклянного электрода применяют стеклянные катионообменные мембраны, обладающие проводимостью не для протонов, а для ионов щелочных металлов, например Na+. На стеклянной мембране, помещенной в водную среду, образуется тонкий (»10–4 мм) слой гидратированной кремниевой кислоты, именно в этом слое происходит обмен протонами между раствором и мембраной. В схеме реакций, описывающих работу электрода, появляются стадии ионного обмена на границе раствор–стекло. Это усложняет теоретическое описание процесса, но не меняет принцип возникновения электродного потенциала. С практической точки зрения особенностью рН-метрии с использованием стеклянного электрода является необходимость специфической подготовки в работе и калибровки по стандартным буферным растворам. Процедура подготовки к работе нового стеклянного электрода описана в прил. 1.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.