Разность потенциалов между вспомогательным электродом и внешним электродом сравнения складывается из четырёх скачков потенциала на межфазных граница (j1, j2, jх, j3). В простом случае, когда в обмене участвует лишь один тип ионов, величина jх зависит только от активности (концентрации) определяемого иона и материала мембраны. Как отмечалось выше, потенциал такого гальванического элемента описывается уравнением, схожим с уравнением Нернста:
![]() ,
(9)
,
(9)
где EМ – сумма ЭДС, возникающих на границах раздела фаз:
1)между внутренним электродом сравнения и внутренним стандартным раствором определяемого иона (j1);
2)между внутренним стандартным раствором определяемого иона и мембраной (j2);
3)между внешним электродом сравнения и исследуемым раствором (j3).
Если определяемый ион (А) имеет заряд ZAиактивность aA, то уравнение (9) выглядит так:
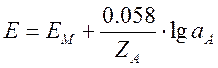 .
(10)
.
(10)
В более сложном случае, когда кроме определяемого иона в растворе имеются другие мешающие ионы, способные вступать в реакции ионного обмена с мембраной, в уравнение (10) вводят показатель, учитывающий их влияние:
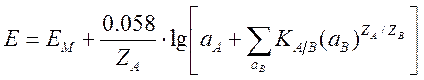 ,
,
где aA – активность определяемого иона; aB – активность мешающих ионов; ZA – заряд определяемого иона с учетом знака, ZB – заряд мешающего постороннего иона с учетом знака; KA/B – потенциометрический коэффициент селективности. Хорошие ионоселективные электроды обладают коэффициентом селективности 10-3–10-5, т. е. тысячекратные и даже большие избытки посторонних ионов не влияют на работу электрода. Потенциометрический коэффициент селективности стеклянного электрода – 10-10–10-14. .На сегодняшний день это лучший ион-селективный электрод.
На рис. 10 показан внешний вид ион-селективного электрода серии ЭЛИТ и приведены основные технические характеристики электродов этой серии при определении различный ионов.
|
|
|
Рис. 10. Ион-селективный электрод серии ЭЛИТ
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.