Новосибирский государственный университет
Факультет естественных наук
Кафедра физической химии
Лабораторная работа
Спектрофотометрия
Кислотно-основные равновесия
Выполнили: Габриенко А.А.,
Должников Д.С. группа 343
Новосибирск, 2005
Основные понятия спектроскопии
В аналитических целях спектроскопия используется для идентификации химических соединений и для определения концентрации веществ в растворах или смесях. Применение оптической спектроскопии к задачам физической химии позволяет изучать строение и энергетические свойства молекул, исследовать равновесия, в том числе кислотно-основные, кинетику химических реакций и т. д. Объектами спектроскопических исследований могут являться вещества в любых агрегатных состояниях.
Современная спектроскопия базируется на представлениях квантовой теории, в соответствии с которыми любая атомная или молекулярная система является устойчивой только в определенных стационарных состояниях. Любые изменения энергии системы связаны со скачкообразным переходом из одного состояния в другое. Подобные переходы могут быть как безызлу-чательными, так и радиационными. Именно радиационные переходы, при которых вещество поглощает или излучает электромагнитное излучение, являются объектом изучения спектроскопии.
Поглощение кванта электромагнитной энергии приводит к тому, что система (атом, молекула, ион, радикал и т. д.) переходит из основного состояния в возбужденное:
А + hν → A*.
По формуле Планка величина кванта поглощенной энергии определяется разностью энергий конечного и начального состояний системы:
hν = hc/λ = Ek – Ei = ΔE.
Способность вещества поглощать свет от внешнего источника обычно характеризуется оптической плотностью – D. По определению, оптическая плотность есть мера непрозрачности вещества, равная десятичному логарифму отношения интенсивности излучения, падающего на слой вещества, I0, к интенсивности излучения, прошедшего через вещество и ослабленного в результате поглощения и рассеяния, I:
D = lg(Io/I).
Зависимость D от длины волны λ или волнового числа υ и называется спектром поглощения данного вещества. После прохождения через вещество спектральный состав света изменяется, что воспринимается глазом как окраска образца.
Основной закон спектроскопии
В основе всех количественных измерений в спектроскопии лежит закон Бугера-Ламберта-Бэра, который связывает способность вещества поглощать свет с концентрацией данного вещества.
Этот закон можно вывести, исходя из следующих соображений. Рассмотрим прохождение монохроматического света с длиной волны λ через кювету с исследуемым веществом. Тогда интенсивность светового потока, выходящего из кюветы (Iλ) будет меньше интенсивности света, падающего на кювету (I0). Поглощение света dIλ в бесконечно тонком слое данного вещества толщиной dx пропорционально падающему световому потоку Iλ и молярной концентрации поглощающих свет частиц С.
dIλ = –ε ́ · Iλ · C · dx,
Интегрируя это выражение получим:
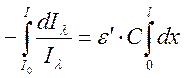 ,
, ![]() .
.
Зависимость, характеризующую ослабление света веществом, можно представить в логарифмическом виде
lg(I0/I) = ελ – C · l = Dλ,
где I и Iо – интенсивность прошедшего и падающего на образец света; С – молярная концентрация; l – длина оптического пути; ελ – коэффициент пропорциональности, называемый молярным коэффициентом поглощения или коэффициентом экстинкции вещества. Таким образом, оптическая плотность линейно связана с концентрацией:
Dλ = ελ · С · l.
Поскольку по традиции в спектроскопии длина кюветы l измеряется в см, концентрация вещества – в моль/л, а оптическая плотность – безразмерная величина, то единицей измерения коэффициента экстинкции является л·молъ-1·см-1. Величина, обратная коэффициенту экстинкции, равна толщине слоя раствора с концентрацией 1,0 моль/л, в котором интенсивность света уменьшается в 10 раз.
Для процесса поглощения света веществом характерна аддитивность: если в образце присутствуют несколько поглощающих форм, то оптическая плотность на данной длине волны будет определяться суммой поглощения каждой из них:
Dλ= l·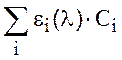 .
.
Поэтому при исследовании растворов требуется учитывать, что световой поток может поглощаться и молекулами растворителя, концентрация которых обычно на несколько порядков превышает концентрацию растворенного вещества. Так что необходимым условием для получения спектра поглощения какого-либо вещества в растворе является полная прозрачность в данной спектральной области используемого растворителя ελs << ελi.
Особенности проведения спектроскопических экспериментов
Закон БЛБ предсказывает наличие линейной зависимости между оптической плотностью вещества и его молярной концентрацией, значение коэффициента пропорциональности ε предполагается постоянным, не зависящим от условий проведения эксперимента. Но на практике нередки случаи, когда регистрируются отклонения от линейной зависимости.
Рассмотрим, какие факторы могут оказывать влияние на величину коэффициента экстинкции ε.
1. Величина ε может зависеть от интенсивности падающего света lо.
2. На численное значение коэффициента экстинкции могут влиять внешние условия - температура, давление (для газов), растворитель, Так, с ростом температуры может наблюдаться уширение полосы поглощения, которое обусловлено изменением заселенности колебательных уровней, отвечающих основному электронному состоянию. Изменение растворителя (например, с полярного на неполярный) может сказываться на положении λмакс исследуемой полосы поглощения.
3. Химические причины отклонений от закона БЛБ. Они обусловлены наличием сложных взаимодействий между различными поглощающими частицами в растворе. Тогда с изменением концентрации этих веществ положение равновесия может смещаться, что будет сказываться на спектре поглощения. В этом случае даже в разбавленных растворах не соблюдается постоянство ε. Среди факторов, влияющих на положение равновесия, следует указать температуру и ионную силу раствора.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.