Кислотой называют частицу, способную отдавать протон, а основанием – частицу, способную принимать протон. Схематически кислотно-основное равновесие может быть записано в следующем виде:
НxАу ↔ H+ + Нx-1 Аy–,
где НxАу – сопряженная кислота, Нx-1 Аy– – сопряженное основание.
Данное равновесие характеризуется константой кислотности, которая определяется произведением активностей участвующих в равновесии частиц в степенях, соответствующих стехиометрическим коэффициентам:
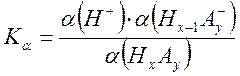 .
.
Причем в зависимости от рассматриваемого равновесия одна и та же частица может служить как кислотой, так и основанием.
Рассмотрим процесс диссоциации слабой одноосновной кислоты в водном растворе:
НА + Н2О↔ А- + Н3O+
С0(1–α) С0 α С0 α
Тогда выражение для константы диссоциации записывается как
Kα = 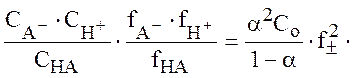
В случае достаточно разбавленных водных растворов коэффициент активности нейтральной молекулы fHA полагается равным 1 , среднеионный коэффициент активности f± можно рассчитать, используя формулу Дебая-Хюккеля. Степень диссоциации определяется из спектроскопических данных по описанной ниже методике.
Поскольку вода и Н3О+ не поглощают свет в видимой и ближней ультрафиолетовой областях спектра, оптическая плотность раствора в этом диапазоне длин волн будет определяться только поглощением молекул кислоты и анионов кислотного остатка:
Dλ = l · (εHACHA + εA- CA-).
Преобразование формулы к виду
Dλ = l · Co (εHA + α · ( εA- - εHA ))
позволяет продемонстрировать, что оптическая плотность раствора является функцией от степени диссоциации слабой кислоты и, значит, существенно зависит от рН среды. При добавлении сильных кислот исследуемое равно
|
εНА = Dкисл / (Со· l); εA- = Dщел / (С0· l).
Подставляя эти значения в формулу для константы кислотности, можно найти концентрации обеих форм в растворе. Если все измерения проводятся в кюветах с одинаковой толщиной оптического слоя, то степень диссоциации кислоты НА можно выразить непосредственно в величинах оптической плотности:
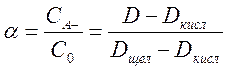 .
.
Однако определение константы диссоциации слабой кислоты в воде по формулам, приведенным выше, часто приводит к неудовлетворительным результатам из-за наличия в растворе неучтенных примесей (в том числе углекислоты). Эта трудность исключается, если проводить измерения в буферных растворах с известным значением рН. Тогда выражение для константы диссоциации записывается в виде
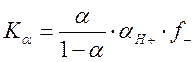 .
.
Преимуществом
расчета по формуле 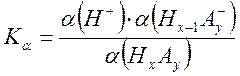 является отсутствие в ней значения
исходной концентрации кислоты С0. Степень диссоциации находят
по спектроскопическим данным, активность ионов водорода определяется независимым
методом, а коэффициент активности аниона кислотного остатка рассчитывают по
формуле Дебая-Хюккеля.
является отсутствие в ней значения
исходной концентрации кислоты С0. Степень диссоциации находят
по спектроскопическим данным, активность ионов водорода определяется независимым
методом, а коэффициент активности аниона кислотного остатка рассчитывают по
формуле Дебая-Хюккеля.
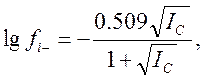
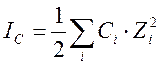 ,
,
где IС – ионная сила раствора, Сi и Zi – молярная концентрация и заряд иона; при этом суммирование производится по всем присутствующим в растворе ионам Обычно концентрации реагентов, образующих буферный раствор, значительно превышают концентрации исследуемых веществ Поэтому ионная сила, например, уксусно-ацетатного буферного раствора будет определяться преимущественно концентрацией ацетата натрия.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.