Глава 6
ИЗМЕРЕНИЕ КОНЦЕНТРАЦИИ
6.1. ИЗМЕРЕНИЯ В ХИМИЧЕСКОМ АНАЛИЗЕ
Концентрация, наряду с температурой и давлением, является основным параметром, определяющим термодинамическое состояние системы. С другой стороны, концентрация компонентов является одним из свойств вещества. Примером может служить влажность, которую рассматривают даже как самостоятельную физическую величину. В действительности влажность определяется концентрацией воды в газообразных, жидких или твердых смесях. В качестве другого примера можно привести железо. В зависимости от концентрации в нем углерода получается целый набор материалов от чистого железа до чугунов различных марок. Присутствие в железе дополнительно ряда других металлов в качестве примесей, прежде всего хрома, никеля, марганца и т. п. позволяет получить набор различных марок стали.
Концентрация — величина, характеризующая относительное содержание данного компонента в многокомпонентной термодинамической системе. В химическом анализе такой термодинамической системой является анализируемый объект. Химический анализ в общем случае состоит из качественного и количественного анализов. Задачей качественного анализа является определение химической природы компонентов, из которых состоит анализируемый объект. Задачей количественного анализа является определение концентрации этих компонентов. При этом под компонентами вещественной системы понимают атомы, ионы, молекулы, радикалы и макромолекулы, а в общем виде — химические элементы и соединения. Употребляя термин „химический анализ", подчеркивают его основную цель — определение химического состава *, включая определение концентрации компонентов, составляющих данную вещественную систему. В то же время методы, используемые для достижения этой цели, могут быть как химическими, так и физико-химическими или физическими.
· Часто встречается термин "измерение состава". Использование этого термина не рекомендуется, так как состав не относится к физическим величинам. То же самое относится к термину "содержание компонента", употребляемому вместо термина "концентрация компонента".
·
Получение достоверных результатов о концентрации компонентов в анализируемом объекте требует решения проблем воспроизведения единицы концентрации, обеспечения единства измерения концентрации и контроля правильности полученных результатов. Решение всех перечисленных выше проблем возможно только в тесной взаимосвязи метрологических правил, изложенных в предыдущих разделах, с теоретическими основами химического анализа. Принципиальным при этом является положение о том, что теоретические основы аналитической химии едины и нет отдельно теориикачественного и теории количественного анализа. Отсюда следует, что для выявления специфики концентрации как измеряемой физической величины необходимо рассмотреть с позиций метрологии обе составляющее" химического анализа.
Для осуществления измерения как физического эксперимента необходимы объект и средство измерений. Однако этих двух составляющих недостаточно для проведения измерения. Связующим звеном, превращающим измерение в физический процесс, является метод измерения. Для наглядности поясним это рис. 133.

В дальнейшем будем исходить из следующих определений принципа, метода и методики измерения.
Принцип измерения — научная основа метода измерения.
Метод измерения — комплекс теоретических положений и практических операций в общем виде, используемых при проведении измерений в соответствии с принятым принципом.
Методика измерений — детальное описание практических операций и теоретических положений, используемых при проведении измерений в соответствии с принятым методом.
Перед обсуждением особенностей измерений при проведении химического анализа введем временно следующие допущения:
1. Анализу подвергается весь образец, а не отобранная специальным образом проба.
2. Образец гомогенен и все анализируемые компоненты находятся в аналитически активной форме.
Введение таких допущений преследует цель свести химический анализ к измерению, благодаря временному и, естественно, чисто условному исключению из рассмотрения таких этапов химического анализа, как пробоотбор и пробоподготовка. Эти допущения необходимы, чтобы в центре обсуждения вначале оставались бы только вопросы, связанные с видом физических—величин, измеряемых при проведении как количественного, так и качественного анализов.
Принцип измерения, характеризуется физическим явлением, возникающим в результате взаимодействия какого-либо внешнего возмущающего фактора на анализируемое вещество. В результате воздействия происходят взаимодействия внешних возмущающих факторов с компонентами вещества, классифицируемые как упругие и неупругие взаимодействия*.
Упругие взаимодействия. В качестве возмущающих факторов при упругих взаимодействиях выступают электромагнитное излучение или потоки элементарных частиц. Условием упругих взаимодействии является выполнение требования
S
DE
![]() = 0,
= 0,
где E ![]() — кинетическая энергия.
— кинетическая энергия.
Следовательно, энергия излучения в ходе взаимодействия не изменяется. Внутренняя энергия компонентов анализируемого вещества также не изменяется. В то же время происходит изменение пространственной структуры излучения, обусловленное структурой вещества. В результате упругого взаимодействия происходит лишь изменение направления излучения. Измеряемая при этом величина w является преимущественно тригонометрической функцией распределения энергии:
w
= f (sin I![]() ),
),
где i![]() —
интенсивность.
—
интенсивность.
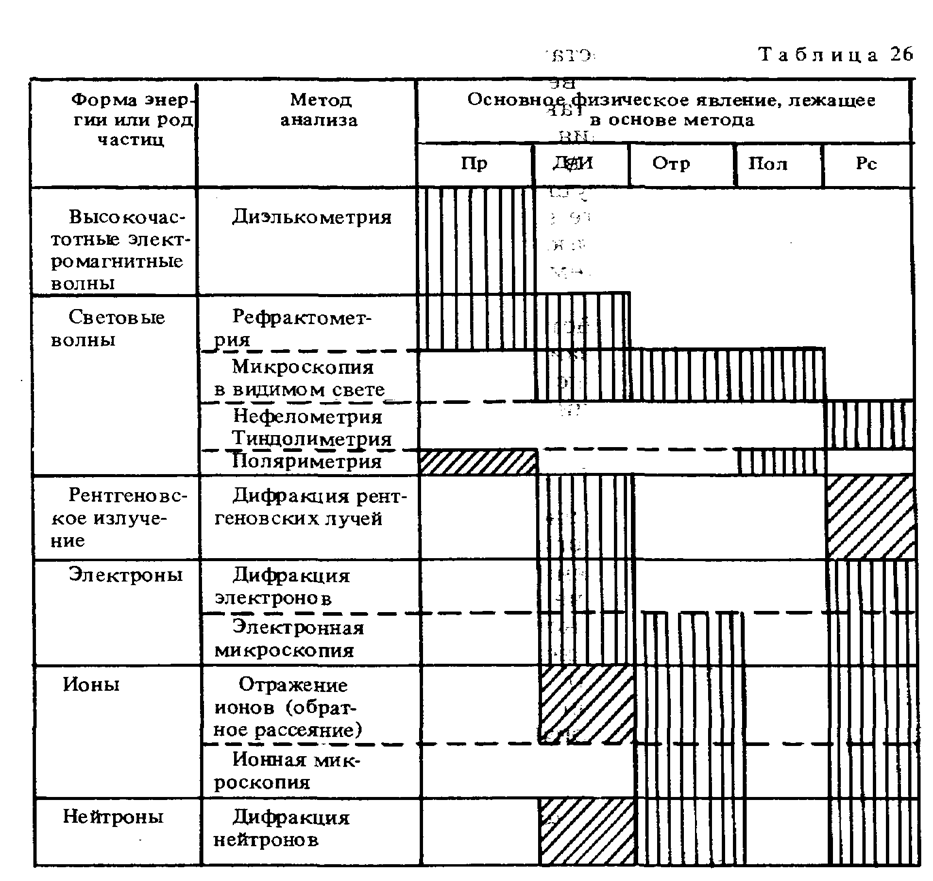
В качестве примера в табл. 26 приведены методы анализа, основанные на упругих взаимодействиях (волновых явлениях) . Принципы измерения в этих методах анализа основываются на таких физических явлениях, как преломление (Пр), дифракция — интерференция (Д/И), отражение (Отр), поляризация (Пол) и рассеяние (Рс).
* В основу изложения данного вопроса положены обобщения, полученные К. Данцером с соавторами.
Неупругие взаимодействия. Неупругие взаимодействия составляют основу значительно большей группы методов анализа. При этом виде взаимодействия анализируемого вещества с внешним источником энергии происходит как изменение энергии, поступающей от внешней системы, так и
изменение внутренней энергии вещества. Однако соблюдается условие
S DE ![]() = -S D U,
= -S D U,
т. е.
каждому изменению кинетической энергии (E![]() ) однозначно соответствует изменение потенциальной
энергии (U). В табл. 27 приведены методы анализа, основанные на
неупругих взаимодействиях.
) однозначно соответствует изменение потенциальной
энергии (U). В табл. 27 приведены методы анализа, основанные на
неупругих взаимодействиях.
Важно
отметить, что конкретные значения DU и соответственно DE ![]() характеризуют химическую природу компонентов
анализируемого вещества. В то же время сумма всех одинаковых квантов DЕ,
определяющая интенсивность, закономерно связана с количеством каждого
компонента.
характеризуют химическую природу компонентов
анализируемого вещества. В то же время сумма всех одинаковых квантов DЕ,
определяющая интенсивность, закономерно связана с количеством каждого
компонента.
Таблица 27
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.