Как следует из этой последовательности, предпочтение отдается абсолютным методам анализа. Это естественно, так как только на их основе в принципе может быть воспроизведена единица концентрации с установленным размером.
Недостатком абсолютных методов анализа является ограниченная область их применения, связанная как с природой и диапазоном концентрации определяемых компонентов, так и с влиянием матрицы. Кроме того, выбор абсолютных методов анализа весьма ограничен. Аттестация с применением образцовых методов и проведением межлабораторных сличений на их основе не позволяет в полной мере гарантировать отсутствие значимых отклонений от установленных размеров единиц концентрации. Если аттестация абсолютным методом невозможна, то более предпочтителен подход к передаче размера единиц концентрации, основанный на применении высокочистых веществ, для которых установлено постоянство ряда их свойств. Поэтому после краткого обзора известных абсолютных методов анализа целесообразно обсудитьроль высокочистых веществ в обеспечении единства измерений концентрации.
Абсолютные методы анализа. В разд. 6,1 было отмечено, что уравнения связи, в частности, (40) лишь в редких случаях могут быть представлены строгими зависимостями, связывающими изменения какого-либо свойства с концентрацией. Абсолютные методы анализа, как следует из их определения, как раз и представляют собой этот редкий случай. Ознакомимся с принципами абсолютных методов, обращая внимание прежде всего на физические величины, подлежащие измерениям.
Гравиметрия. Принцип гравиметрического анализа основан на законе постоянных и кратных отношений. Метод анализа заключается в определении массы продуктов реакции взаимодействия, выделяющихся при этом в виде осадка. Иногда этим методом определяют и газообразные продукты реакции после их "перевода, в осадок или поглощения. Уравнение связи прямого гравиметрического анализа для общего случая, представленного уравнением
записывается в следующем виде:
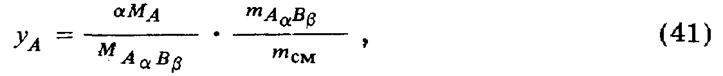
где УA — массовая доля компонента A; mA = F • тAaBb — масса компонента А в смеси; mAaBb — масса продукта реакций;
F = 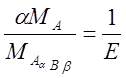 - стехиометрический фактор
- стехиометрический фактор
МA — атомная масса исследуемого компонента; МAaBb--- молярная масса продуктов реакции; тcm --- масса анализируемого вещества, содержащего компонент А.
Пример 63. Определить концентрацию углекислого кальция (СаCО3) в природном известняке, если 2,0344 г известняка при растворении его в кислоте выделяют 0,8802 г углекислого газа. Масса поглощенного щелочью углекислого газа определялась взвешиванием.
Решение. Из уравнения реакции
СаСОэ + 2НС1®СаС1, + Н, О + CO2в соответствии с уравнением (41) следует:
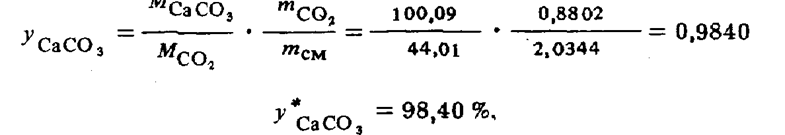
В гравиметрии физической величиной, связанной с концентрацией и подлежащей измерению, является масса.
Волюмометрия. Принцип газоволюмометрии основан на уравнении идеального газа. Метод объемного газового анализа заключается в определении количества газообразных продуктов реакции путем поглощения одного из компонентов газовой смеси раствором соответствующего реактива и измерении вызванного этим уменьшения объема смеси.
Уравнение связи для газоволюмометрии при постоянном давлении р и температуре Т имеет следующий вид:

MA p
где тA = ——— • VA ; МA — молярная масса компонента А ',
RT
VA — парциальный объем компонента А, соответствующий разности объемов.
Для смесей газов концентрация таким способом определяется, как правило, в молярных долях (хA = VA/V) .
Пример 64. Рассмотрим ту же задачу, что и в примере 63. Однако вместо поглощения выделившегося углекислого газа используем измерение объема этого газа. Для приведенных числовых данных объем выделившегося COi составил 499,1 см3 при температуре 25,2° С и давлении 0,99 • 10s Па.
Решение. Первым этапом является приведение измеренного объема к нормальным условиям (р = 1,01 • 10s Па; Т = 273,16 К):
p VCO2 273,15 0,99 * 105 * 499,1* 273,15
VoCO2 = --------------------------------- = -------------------------------------- =
(273,15 + t ) * 1,01 * 105 298,4 * 1,01 * 105
= 447,8 см3 .
Концентрация углекислого кальция рассчитывается по уравнению (42) с учетом того, что в соответствии с уравнением химической реакции каждому молю выделившегося СО2 отвечает моль СаСО3:
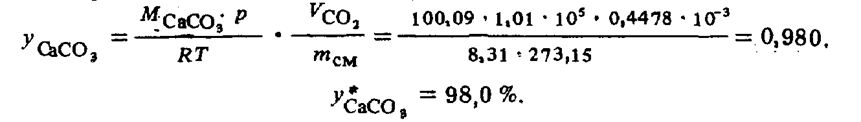
Отклонение данного результата от полученного для тех же исходных условий (см. пример 63) обусловлено отклонениями р, V, Т — зависимости для углекислого газа от закона для идеального газа.
В волюмометрии физическими величинами, связанными с концентрацией и подлежащими измерению, являются объем, давление, температура и масса.
Кулонометрия. Принцип кулонометрии основан на законе Фарадея. Метод заключается в измерении количества электричества, прошедшего через электролитическую ячейку при определенной электрохимической реакции. Уравнение связи для кулонометрического метода в предположении, что выход по току составляет 100 % и все побочные реакции отсутствуют, записывается следующим образом:
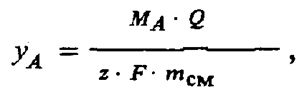
где МA — молярная масса определяемого компонента; Q = / t — количество электричества;
MAQ MA I t
mA = ——— = ———— — масса компонента А в смеси;
zF zF
z — число электронов, участвующих в электрохимической реакции; F — постоянная Фарадея.
Концентрация этим методом определяется, как правило, в массовых долях.
Кулонометрический метод анализа представляет в настоящее время один из наиболее точных методов, обеспечивающих возможность определения концентрации основного компонента до 0,99999 массовых долей.
Как следует из уравнения связи, измеряемыми физическими величинами в кулонометрическом методе анализа являются сила тока, время и масса.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.