Методы анализа, основанные на химических реакциях. В общем виде химическую реакцию можно представить уравнением
аА
+ bВ![]() = gC
+ dD,
= gC
+ dD,
Где А, В, С, D — исходные компоненты и продукты реакции соответственно; а, b, g, d, -стехиометрические коэффициенты реакции.
На основании измерения хода химической реакции, определения концентрации продуктов реакции и связанных с этим изменений термодинамических характеристик системы получают информацию о химической природе и концентрации компонентов анализируемого вещества (рис. 137).
Химические реакции при определённых условиях составляют основу абсолютных методов измерения концентрации. Это предопределяет их непреходящее значение для воспроизведения единиц концентрации. В табл. 28 указан перечень физических величин, подлежащих измерению при проведении химических методов анализа.
——————————
* См. Данцер К., Тан Э., Мольх Д. Аналитика: Системат. обзор.
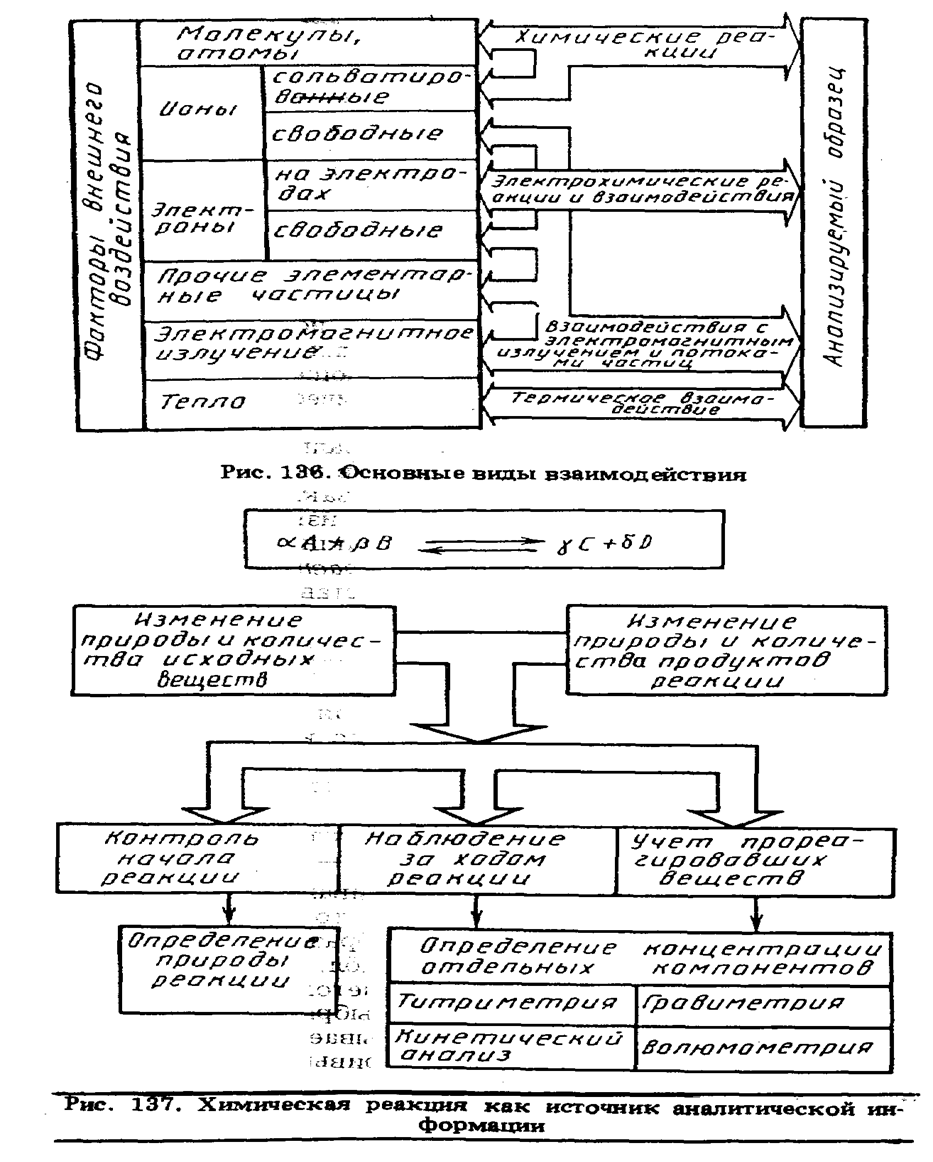
Таблица 28
|
Функциональная зависимость. |
||
|
Физические величины |
Примечание |
|
|
Масса m |
R- универсальная газовая постоянная |
|
|
Объем V |
Т- температура |
|
|
Давление r |
Р= cRT |
|
|
Скорость реакции k |
k = dv/dt |
|
|
Время реакции t |
Рассмотрим один из принципов, используемый в методах анализа, основанных на химических реакциях. Остановим свой выбор на титриметрии, являющейся примером использования самых разнообразных физических свойств при решении аналитических задач.
Принцип титриметрического анализа основан на скачкообразном изменении ряда свойств в момент окончания химической реакции. Метод анализа заключается в измерении объема раствора реагента с точно "известной концентрацией, необходимого для проведения реакции с определяемым ионом до ее полного завершения. Уравнение связи для общего случая прямого титрования представляет собой следующее выражение:
yA = 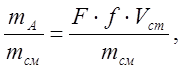
где
у![]() -
концентрация, выраженная в массовой доле; mA = F • f
• V
-
концентрация, выраженная в массовой доле; mA = F • f
• V![]() - масса
определяемого компонента; m
- масса
определяемого компонента; m![]() -масса
смеси;
-масса
смеси;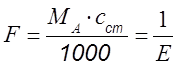 - стехиометрический
фактор; сст - молярная концентрация титранта ; f =c
- стехиометрический
фактор; сст - молярная концентрация титранта ; f =c![]() /с
/с![]() — поправочный коэффициент; V
— поправочный коэффициент; V![]() — объем титранта, затраченный для достижения точки
эквивалентности.
— объем титранта, затраченный для достижения точки
эквивалентности.
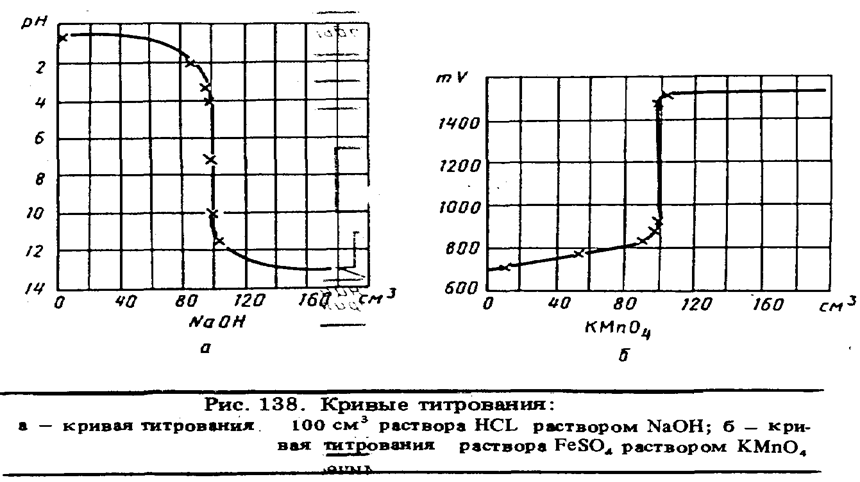
Для установления конечной точки титрования используют измерения самых разнообразных свойств. Представление об этих свойствах дает табл. 29, в которой представлен обзор инструментальных методов титрования. Графическая зависимость изменения выбранного свойства от объема добавляемого титранта называется кривой титрования. На рис. 138 показаны примеры кривых титрования.
Важно подчеркнуть, что в методах титрования измеряемой величиной является
объем реагента, а остальные перечисленные в табл. 29 величины служат лишь
для точного определения объема в конечной точке титрования, т. е. они используются
в данном методе анализа только для индикации.
Методы анализа, основанные на электрохимических реакциях. Основу электрохимических методов составляют неспецифические процессы, протекающие на электродах, а также специфические процессы, обусловленные электрохимическими реакциями (рис. 139). Эта группа методов также характеризуется большим разнообразием физических свойств, используемых как для качественного анализа, так и для определения концентрации. Те физические величины, которые входят в уравнение связи, подлежат измерению при проведении анализа. В табл. 30 приведен перечень таких электрических величин.
Методы анализа, основанные на термических процессах. Основу термических процессов составляет изменение энтальпии (ΔH):
ΔH
= Cq ![]() = m · cq ·Δ T.
= m · cq ·Δ T.
Оно является результирующим и включает все энтальпийные вклады анализируемой смеси, перечисленные в табл. 31. В зависимости от условий эксперимента различают энтальпиметрические и термометрические способы анализа, что нашло отражение в классификации термических методов анализа, представленных на рис. 140.
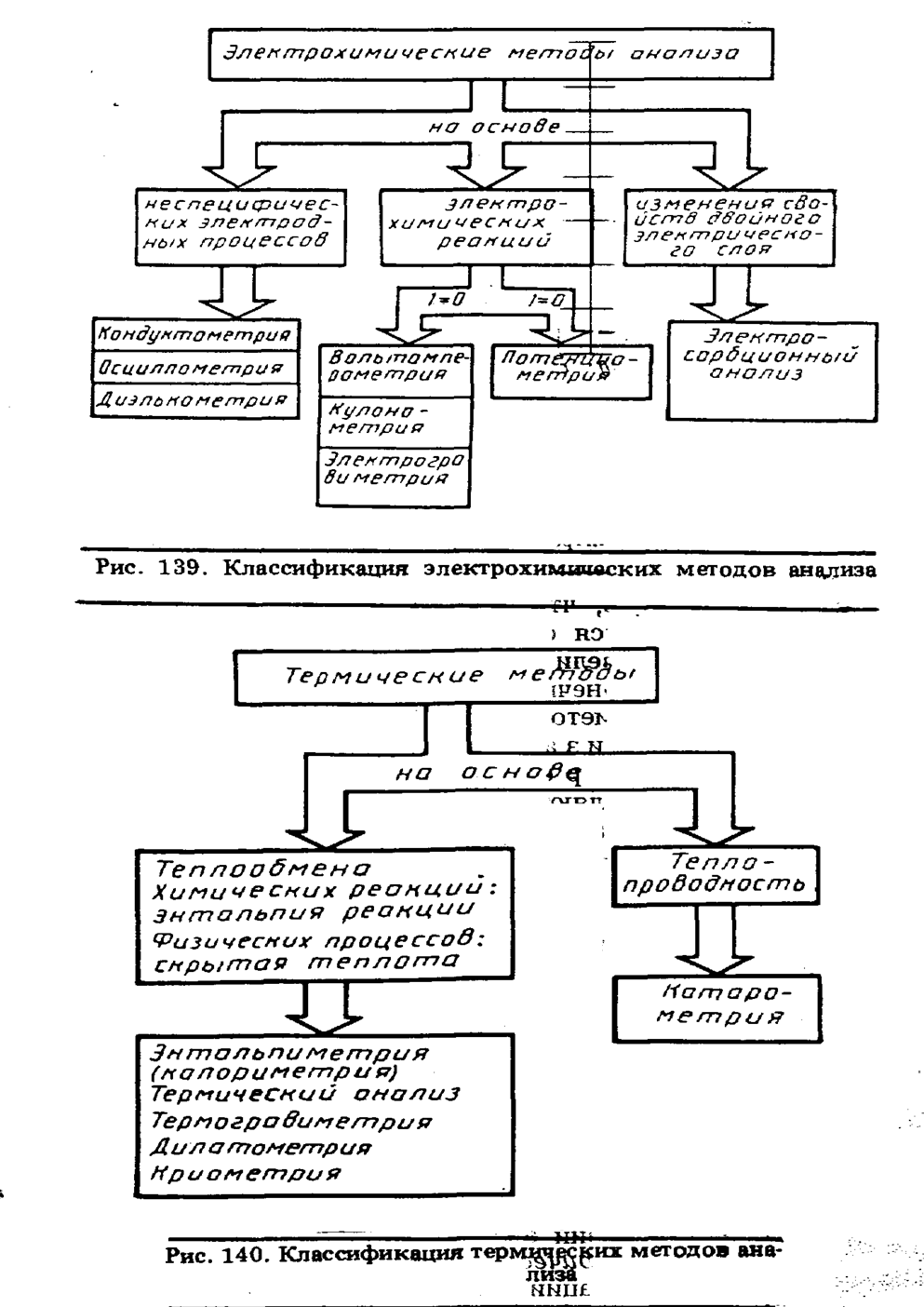
Таблица 29
|
Метод титрования |
Аналитическая функция |
Измеряемое свойство (величина) |
|
|
1. Оптические методы |
|||
|
1.1. |
Колориметрический |
|
Экстинкция (Ε |
|
|
|||
|
1.2. |
Фотометрический |
|
Экстинкция |
|
1.3. |
Флуориметрический |
IF= |
Интенсивность флуоресценции (IF) |
|
1.4. |
Турбидиметрический |
ESλ= |
Кажущаяся экстинкция (ЕS,λ) |
|
1.5. |
Нефелометрический |
FES= |
Интенсивность рассеянного света (фез) |
|
1.6. |
Поляриметрический |
a= |
Угол (вращательная способность растворов a) |
|
1.7. |
Интерферометрический |
nD - nD= |
Показатель преломления (nD) |
|
1.8. |
Пламенно-фотометрический |
I= |
Интенсивность излучения (I) |
|
2. Электрохимические методы |
|||
|
2.1. |
Кондуктометрический |
K=f(V) |
Электропроводность (к) |
|
2.2. |
Осциллометрический |
Yw=f(V) |
Активная составляющая проводимости ячейки (Yw) |
|
Yb=f(V) |
Реактивная составляющая проводимости ячейки (Yb ) |
||
|
2.3. |
Диэлькометрия |
е=f(V) |
Диэлектрическая проницаемость (е ) |
|
2.4. |
Потенциометрический |
E=f(V) |
Потенциал электрода (Е} |
|
2.5. |
Амперо метрический |
I=f(V)E=0 |
Предельный диффузионный ток (/) |
|
2.6. |
Вольт-амперетрический |
E=f(V)i |
Потенциал электрода (Е) |
|
3. Термические методы |
|||
|
3.1. |
Термометрический |
T=f(V) |
Температура (Т) |
|
3.2. |
Дифференциально- термометрический |
D T=f(V) |
Температура |
|
3.3. |
Энталъпиметрический |
DH= f(V) |
Энтальпия (DH) |
|
3.4. |
Криоскопический |
DT= f(V) |
Температура |
|
3.5. |
Дилатометрический |
l = f(V) |
Длина (l) |
|
4. Прочие методы |
|||
|
4.1. |
Вискозиметрический |
tF1= f(V) |
Время истечения (tF1) |
|
4.2. |
Сталагмометрический |
tTn= f(V) |
Время падения капли (tTn) |
|
4.3. |
Радиометрический |
Z= f(V) |
Радиоактивность (скорость счета Z в импульсах в секунду) |
|
4.4. |
Магнитометрический |
х= f(V) |
Магнитная проницаемость (х) |
|
4.5. |
Акустический |
n= f(V |
Скорость звука (n) |
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.