Таблица 30
|
Измеряемая величина |
Функциональная зависимость |
Обозначение |
|
Напряжение U |
||
|
Потенциал электрода Е |
||
|
Сила тока I |
||
|
Плотность тока I |
i= I/S |
S - поверхность электрода |
|
Сопротивление R |
R = U /I |
|
|
Удельное сопротивление s |
s = RS/d |
d - расстояние между электродами |
|
Проводимость G |
G = 1 / R |
|
|
Удельная электропроводность к |
к = 1/ s |
|
|
Импеданс Z |
= U Z/ I~ |
|Z| — кажущееся сопротивление |
|
Z=Zw+jZb |
|Zw| — действительное сопротивление |
|
|
|Z| = |
|Zb|— реактивное сопротивление |
|
|
Zb=RL-Rc |
RL - индуктивное сопротивление |
|
|
RL =wL |
Rc — емкостное сопротивление |
|
|
rc= 1/wC |
С — емкость |
|
|
w — частота переменного тока |
||
|
Проводимость переменного тока Y |
Y = 1/Z |
|
|
Количество электричества |
Q=I×t |
t - время |
|
Емкость С |
C=Q/U |
|
|
Диэлектрическая проницаемость (относительная) е |
||
|
Тангенс угла диэлектрических потерь tg d |
Таблица 31
|
Измеряемая величина |
Функциональная зависимость |
Обозначение |
|
|
Энтальпия D H |
|
DH* |
— молярная энтальпия |
|
DH пл |
- энтальпия плавления (кристаллизации) |
||
|
DH исп |
— энтальпия возгонки |
||
|
DH пр |
- энтальпия превращения щения |
||
|
DH разб |
- энтальпия разбавления |
||
|
DH шм |
— энтальпия смесения |
||
|
DH рк |
— энтальпия реакции |
||
|
Температура T |
|||
|
Количество теплоты Q |
Q = Cq • DT = m • Cq DT |
Сq cq |
- теплоемкость - удельная теплоемкость |
|
Теплопроводность lq |
lq =Q/( I• DT ) |
||
Так как всякое изменение в вещественной системе связано с изменением энтальпии, особенно при химических реакциях, термические методы анализа нашли широкое распространение. Для качественного анализа особый интерес представляют определяемые термометрические точки, в которых происходят существенные изменения энтальпии. Температурный сдвиг этих точек используют в количественном анализе. Примером такого метода анализа является криометрия. В табл. 31 представлен перечень физических величин, подлежащих измерению методами анализа, основанными на термических процессах.
Регистрацию изменений агрегатного состояния, измерение энтальпии фазовых переходов и энтальпий реакций обычно производят по диаграммам, представляющим зависимость температуры анализируемого вещества от количества подводимого или отводимого тепла (рис. 141). Часто вместо Т - Н
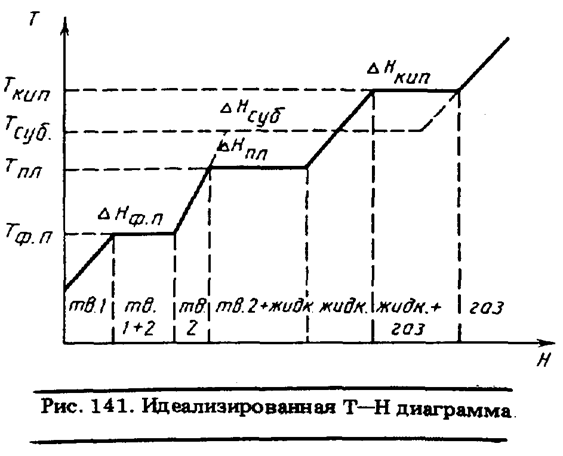
диаграммы строят Т - t диаграмму, обеспечивая для этого постоянство скорости теплоотвода.
В самое последнее время предложено использовать энтальпию для идентификации органических жидкостей, обладающих сложной структурой. В основе этого метода лежит закономерность, в соответствии с которой отношение изменения энтальпии и радиуса частицы при изменении температуры от Ti до T-i является константой, характерной для данной частицы.
![]() = Const =
= Const = ![]()
В табл. 32 приведены значения этих констант для ряда органических веществ.
Таблица 32
|
Соединение |
|
Соединение |
|
|
н-Пентан |
105 |
Бензол |
102 |
|
н-Гексан |
126 |
Толуол |
124 |
|
н-Гептан |
147 |
о-Ксилол |
159 |
|
н-Октан |
168 |
м-Ксилол |
150 |
|
н-Нонан |
190 |
п-Ксилол |
146 |
|
н-Декан |
211 |
Этилбензол |
146 |
|
н-Ундекан |
132 |
Кумол |
175 |
|
н-До декан |
253 |
Циклопентан |
85 |
|
н-Тетрадекан |
295 |
Циклогексан |
107 |
|
н-Гексадекан |
338 |
Метилциклопентан |
107 |
|
2,2,4-Триметилпентан |
144 |
Метилциклогексан |
129 |
|
Изобутилен |
66 |
Нитробензол |
199 |
|
СС11 |
99 |
Метанол |
82 |
Методы анализа, основанные на взаимодействии с электромагнитным и корпускулярным излучением. В зависимости от участка электромагнитного спектра и форм внутренней энергии, определяющих принцип анализа, различают большую группу методов, объединенных под общим наименованием "спектроскопические методы анализа". Обзор этих методов представлен на рис. 142.
Физические величины, используемые в спектральных методах анализа, представлены в табл. 33. Спектры являются наиболее распространенным видом двумерной аналитической информации.При этом частоты или длины волн характеризуют химическую природу компонентов, а соответствующие интенсивности используются для определения концентрации этих компонентов.
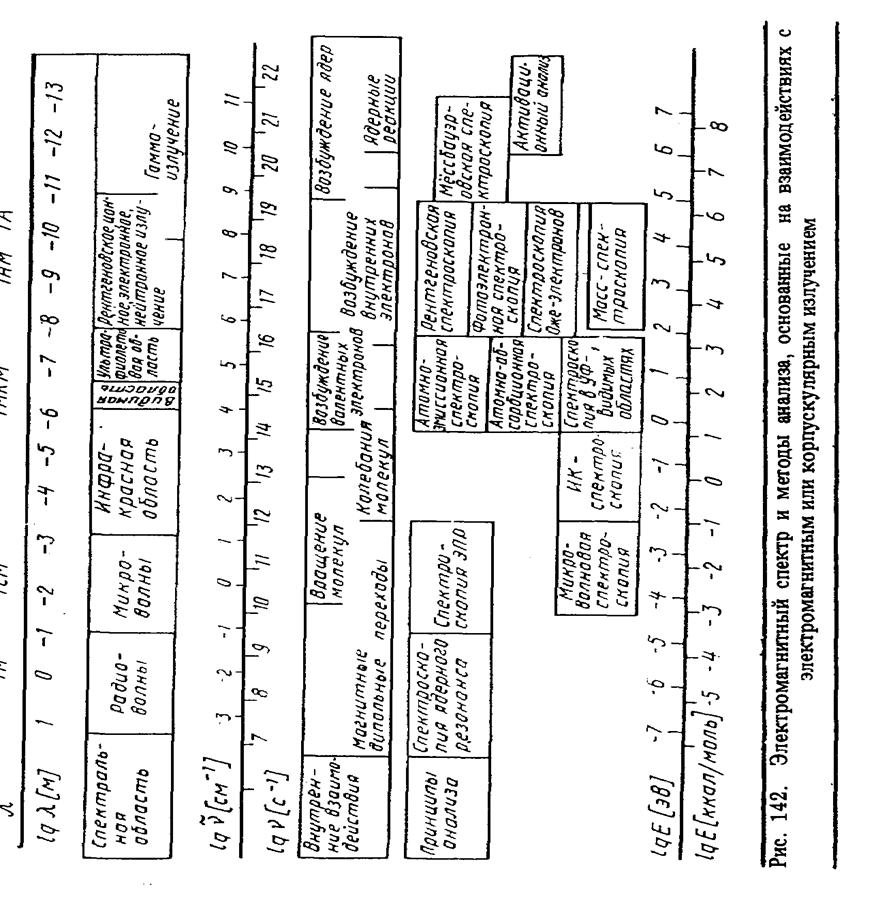
Таблица 33
|
Измеряемая величина |
Функциональная зависимость |
Обозначение |
|
Длина волны l |
||
|
Волновое число |
|
|
|
Частота v |
v=c/l |
с - скорость света |
|
Энергия излучения Е |
E=hv=hc/l |
h - постоянная Планка |
|
Термическая энергия Е |
Е =½ fkT |
k — постоянная Больцмана / - число степеней свободы внутренней энергии |
|
Кинетическая энергия Еk
|
Еk = ½ т
|
т - масса частицы Г - средняя скорость части цы |
|
Длина волны де Бройпя Л. |
l = h/mv |
|
|
Интенсивность l |
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.