Потенциометрия, ионометрия. Принцип измерений основан на возникновении на .электроде, погруженном в раствор электролита, потенциала, связанного с концентрацией электрометрически активной формы анализируемого компонента. При определенных условиях эта связь подчиняется закону Нернста. Метод прямой потенциометрии заключается либо в измерении рН (рН-метрия), либо в измерении активностей других ионов с помощью ионоселективных электродов (ионометрия). Уравнение связи для потенциометрического метода анализа в общем виде представляется выражением:
gi = f ( exp ∆E ) I = 0
Концентрация при этом выражается через массовую концентрацию.
Физической величиной, подлежащей измерению в этом методе, является разность электрических потенциалов, т. е. напряжение.
Криометрия. Принцип криометрического анализа основан на понижении температуры фазового равновесия твердое тело — жидкость под влиянием примесей, присутствующих в образце (пробе). Для идеальных растворов концентрация примесей может быть определена на основании уравнения Ван-дер-Ваальса. Метод измерения заключается в определении температуры фазового равновесия твердое тело—жидкость при плавлении или затвердевании анализируемого вещества. Уравнение связи для криометрического метода анализа высокочистых веществ в предположении отсутствия образования твердых растворов записывается следующим образом:
x2 = A ∆TH ,
где x2-- молярная доля всех примесей, присутствующих в анализируемом образце; А — криоскопическая константа основного компонента; ∆TH — криоскопическое понижение температуры.
Концентрация данным методом определяется в молярных долях. Криометрическим методом в настоящее время возможно достоверное определение суммы всех примесей на уровне 0,00001 молярных долей.
Измеряемыми физическими величинами в данном методе являются температура и время при динамических условиях измерения температуры фазового равновесия, либо температура и количество теплоты в статических условиях измерения температуры фазового равновесия.
Спектральные методы, основанные на поглощении электромагнитного излучения. Принцип измерений основан на неупругих взаимодействиях анализируемой пробы с внешним источником электромагнитного излучения, подчиняющихся закону Ламберта-Беера. Метод заключается в измерении интенсивностей падающего 1V и прошедшего /O через поглощающий слой излучения:
IV = IO e- σv N l (43)
где σV — сечение поглощения; N — концентрация поглощающих частиц; / — длина поглощающего столба.
Концентрация в данном методе выражается числом частиц в единице объема.
Обычно спектральные методы требуют градуировки по образцовым мерам концентрации. В последнее время для анализа концентрации ряда элементов предложен подход, основанный на определении значения силы осциллятора линии, являющейся одной из основных атомных констант. Метод заключается в измерении ширины абсолютно черной линии, для которой поглощенная энергия равна энергии реального контура линии, в соответствии с уравнением
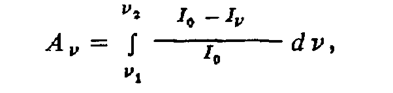
где Аv — эквивалентная ширина линии.
Для оптически тонкого слоя концентрация связана с эквивалентной шириной линии уравнением:

где p,е,т,с - константы; fnm - сила осциллятора линии, характеризующая взаимодействие излучения с веществом (вероятность перехода).
Определяя силу осциллятора линии, для чего разработан ряд способов, или располагая независимыми от градуировки данными о сечении поглощения, можно производить анализ концентрации изолированных свободных атомов в газовой фазе на основании уравнений (43) и (44), представляющих в данном случае уравнения связи абсолютного спектрального метода.
Подводя итог краткому обзору абсолютных методов анализа, следует обратить внимание, что выбор единиц концентрации в каждом методе обусловлен, в первую очередь, теми закономерностями, которые составляют теоретическую основу метода. В то же время при приготовлении образцовых мер, получаемых смешиванием высокочистых веществ, концентрации компонентов смеси могут быть выражены в других единицах. При этом выбор единиц концентрации зависит от вида аналитических приборов, для градуировки которых предназначены конкретные образцовые меры.
6.2.4. Высокочистые вещества и их роль в обеспечении единства измерений концентрации
Вещества, прошедшие самую глубокую очистку, содержат тем не менее какое-то количество примесей. Поэтому при создании на основе таких высокочистых веществ образцовых мер концентрации возможны два подхода:
1. Аттестация высокочистых веществ одним—двумя абсолютными методами.
2. Присвоение высокочистым веществам степени чистоты, близкой к 100 %, на основании постоянства ряда их примесночувствительных свойств при дальнейшей очистке.
Первый подход является метрологически строгим. Однако сфера его применения весьма ограничена, во-первых, из-за небольшого числа абсолютных методов и, во-вторых, из-за довольно узкой области применения каждого абсолютного метода. Поэтому из всего многообразия химических элементов и соединений только незначительная их часть может быть аттестована абсолютными методами. С другой стороны, необходимо иметь в виду, что совершенно не обязательно, чтобы число исходных образцовых мер соответствовало числу известных элементов и соединений. Благодаря возможности химических реакций между веществами, число исходных веществ значительно сокращается.
Так, например, единство измерений концентрации титриметрическими методами анализа при всем их разнообразии (см. табл. 29) обеспечивается всего 8 исходными образцовыми мерами, приведенными в табл. 38.
Таблица 38
|
Наименование |
Концентрация компонента, массовая доля |
|
Калий фталевокислый кислый Калий двухромовокислый Двунатриевая соль этилен-диаминтетра-уксусной кислоты (Трилон Б) Соляная кислота Трехокись мышьяка Натрий хлористый Натрий углекислый безводный Щавелевая кислота |
0.9995 0,9998 0,9980 0,9995 0,9995 0,9990 0.9990 0,9990 |
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.