Стійкість комплексів визначається, у відповідності до закону діючих мас, константою нестійкості. Остання є співвідношенням добутку концентрацій простих іонів. Наприклад, константа нестійкості комплексу [HgJ4]2- дорівнює
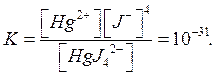
Чим меншою є величина цієї константи (тобто, чим більшим є число, що стоїть зі знаком «-» у показнику ступеня), тим міцнішим буде даний комплекс.
За К. Яцимирським, зменшення стійкості комплексів, які утворюються елементами у водних розчинах, виражається рядами:
для трьохвалентних катіонів:
Ti > Bi > Sb > Fe > Cr > Al; для двохвалентних катіонів:
Hg > Pd > Cd > Pb > Cu > Zn > Ni > Co > Fe > Mn > Mg;
для одновалентних катіонів:
Au > Ag > Cu > Na.
Існує залежність між константою нестійкості комплексу і добутком розчинності гідроокисей елементів: чим нижчою є величина останнього, тим стійкішим буде комплекс. Оскільки існує зв’язок між концентрацією іонів і величиною окислювально-відновлювального потенціалу, то константа нестійкості також пов’язана з Eh: чим нижчою є константа нестійкості тим меншим є окислювально-відновлювальний потенціал системи.
Серед комплексів особливе місце займають комплекси металів з органічними аддендами – хелати. У таких комплексах радикали молекул органічної речовини начебто охоплюють «клешнями» неорганічний іон. Утворення хелатів є характерним для заліза, цинка, марганця, міді і багатьох інших металів. Як приклад наведемо мідну сіль амінооцетової кислоти
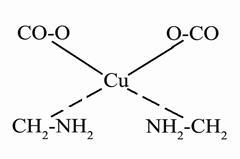
Більшість хелатів добре розчиняється у воді, що збільшує міграційну активність низки металів. До хелатів належать хлорофіл, гемоглобін та ін., які відіграють велику роль у житті рослин та тварин. Метали, що містяться у хелатах, можуть обмінюватися на поглинені катіони ґрунтів і тому є доступними для рослин.
Все сказане вище про форми міграції електролітів у водних розчинах свідчить про велику складність будови істинних розчинів.
Навіть для таких широко розповсюджених у природних водах (і найбільш вивчених) компонентів, як карбонатний, гідрокарбонатний сульфатний аніони, а також катіони кальцію, магнію і натрію, конкретний стан у розчині значною мірою залежить від концентрації останнього. У простій іонній формі вони присутні лише у розбавлених розчинах (при іонній силі менше 0,05). Зі зростанням концентрації спостерігається взаємодія іонів і утворення іонних пар. У висококонцентрованих розсолах взаємодія проявляється достатньо широко.
Якщо взяти до уваги, що зі зміною температури і тиску відбувається перебудова структури води, то уявлення про форми міграції ще більше ускладнюються. Для пересічної більшості компонентів природних вод форми міграції залежать ще й від рН –Eh середовища. Багато з них мають здатність до комплексоутворення.
Колоїдна форма міграції. Ця форма є характерною для підземних вод зони гіпергенезу. Під колоїдами розуміють такий стан речовин у розчині, при якому частки відрізняються дуже повільною дифузією. Вони не здатні проходити крізь перепонки, хоча добре фільтруються крізь фільтрувальний папір. Ці частки можна побачити у мікроскопі. Основною властивістю колоїдних розчинів є термодинамічна нестійкість. Іноді вистачає незначних змін зовнішніх умов, щоб розчинена речовина випала в осадок, який має назву гідрогелю.
Нагадаємо, що причиною особливої поведінки колоїдів і розчинів, які вони утворюють, є розміри часток, наявність у них заряду і велика питома поверхня.
За розмірами колоїди займають проміжне положення між молекулами і іонами, з одного боку, та частками суспензій – з іншого. На відміну від перших колоїди характеризуються існуванням поверхні розділу між частками та водним середовищем, тобто колоїдні розчини належать до гетерогенних систем.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.