В природі окислювально-відновлювальні процеси супроводжуються змінами валентності речовин, що реагують між собою. Окисленням називається реакція віддачі електронів: Fe2+ - e → Fe3+. При відновленні електрони, навпаки, приєднуються: Mn7+ + 5e → Mn2+. Обидві ці реакції – окислення та відновлення завжди протікають одночасно: один елемент окислюється, інший відновлюється.
В розчині, де відбуваються процеси окислення – відновлення, що супроводжуються, з одного боку, віддачею, а з іншого – приєднанням електронів, виникає електричний струм, що характеризується редокс-потенціалом. Величина останнього залежить від співвідношення активних концентрацій іонів різних зарядів у розчині. Характер і напрямок окислювально-відновлювальної реакції визначається тим, як легко відновлювач віддає електрони і як міцно окислювач їх зв’язує. Все це дозволяє відображати окислювально-відновлювальні властивості будь-яких систем за допомогою редокс–потенціалу (Eh), що виражається у вольтах або мілівольтах:
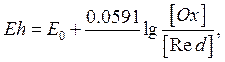 де
де
![]() - нормальний
окислювально-відновлювальний потенціал розчину;
- нормальний
окислювально-відновлювальний потенціал розчину;
![]() - число валентних електронів, що приймають участь у реакції;
- число валентних електронів, що приймають участь у реакції;
![]() - активна концентрація окисленої форми компонента;
- активна концентрація окисленої форми компонента;
![]() - активна концентрація відновленої форми компонента.
- активна концентрація відновленої форми компонента.
Напрямок окислювально-відновлювальних процесів визначається величинами нормальних потенціалів: більш електропозитивна система є окислювачем по відношенню до менш позитивної і будь-якої негативної.
Важливим є питання про взаємовідносини між редокс – потенціалом (Eh) і концентрацією водневих іонів (рН). Воно залежить від конкретних умов реакції. Розрізнюють три можливих випадки: 1) іони водню зовсім не приймають участі у окислювально-відновлювальних реакціях (Eh не залежить від рН); 2) іони водню безпосередньо приймають участь у окислювально-відновлювальних процесах; 3) має місце побічний вплив концентрації водневих іонів, від якого залежить ступінь розчинності компонентів, що приймають участь у реакції.
До числа дуже важливих факторів міграції відносяться температура і тиск.
Температура обумовлює рухливість і агрегатний стан речовини (фізико-хімічні фази), швидкість хімічних реакцій, інтенсивність та послідовність кристалізації з розплавів і розчинів, диференціацію елементів за критичними температурами, внутрішню рівновагу води.
У гідрогеохімічних процесах роль температури і тиску є дуже великою, оскільки переважно від цих параметрів залежить стан внутрішніх рівноваг чистої води і поведінка хімічних елементів у водних розчинах. Тиск і температура пов’язані один з одним. Обидва параметри входять до рівнянь хімічної термодинаміки і тому їхні зміни визначають зсув рівноваг у геохімічних системах у той або інший бік.
Глава 2.
Хімічний склад підземних вод
Різноманітність хімічного складу підземних вод робить задачу з’ясування найбільш характерних геохімічних особливостей однією з найважчих. Тому характеристика підземних вод ґрунтується на з’ясуванні кількісних вмістів елементів.
Однією з головних геохімічних характеристик води є межа вмістів окремих компонентів. Проте, використовуючи лише цей параметр, неможливо виявити найважливіші особливості підземних вод. Як і у гірських породах, у підземних водах є випадки аномального концентрування хімічних елементів що утворюють родовища, формування яких обумовлене певними, специфічними умовами, які не розповсюджуються на всю гідросферу.
2.1. Хімічні елементи у підземних водах
Специфіка тих або інших підземних вод може бути виявлена шляхом визначення кларкових вмістів хімічних елементів. С. Шварцев (1978), використавши понад 25 тисяч хімічних аналізів, вперше підрахував середній вміст 50 хімічних елементів у підземних водах основних ландшафтних зон земної кулі, окремих гідрогеологічних провінцій і зони гіпергенезу в цілому (табл.2.1).
Порівняльний аналіз наведених у таблиці даних доводить, що найбільш прісними по середніх даних є підземні води провінцій з розвитком довічної мерзлоти, які характеризуються гідрокарбонатними магнієво-кальцієвим складом з загальною мінералізацією 0,16 г/дм3, слабкокислим характером
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.