Реактивы:
Молочная кислота
Гидрокарбонат натрия (питьевая сода)
Концентрированный раствор перманганата калия
Ход работы:
В пробирку наливают ~1 мл разбавленной молочной кислоты, нейтрализуют ее раствором соды. Реакция среды должна быть слабощелочной pH~8 (проверяют с помощью универсальной индикаторной бумаги). Затем добавляют около 5 мл концентрированного раствора перманганата калия (раствор становится красно-малинового цвета) и смесь нагревают до кипения (образуется осадок в виде грязно-бурых хлопьев). За счет вторичной спиртовой группы молочная кислота окисляется, и образуется пировиноградная кислота:
toC
3CH3-CH(OH)-COOH + 2KMnO4 ® CH3-CO-COOH + MnO2¯ + 2KOH + 2H2O
Реактивы:
Раствор гидроксида натрия
Раствор сульфата меди
Раствор сегнетовой соли (натриево-калиевая соль винной кислоты)
Ход работы:
В пробирку берут ~2 мл 5%-ного раствора медного купороса и прибавляют несколько капель 10%-ного раствора NaOH - выпадает осадок гидрата окиси меди (II):
CuSO4 + 2NaOH ® Na2SO4 + Cu(OH)2¯
К полученному осадку в пробирку приливают ~2 мл раствора сегнетовой соли и встряхивают. При этом гидрат окиси меди (II) вступает во взаимодействие с сегнетовой солью, полностью растворяется, и жидкость приобретает интенсивную темно-синюю окраску. Получается ярко-синяя растворимая в воде алкоголято-соль винной кислоты
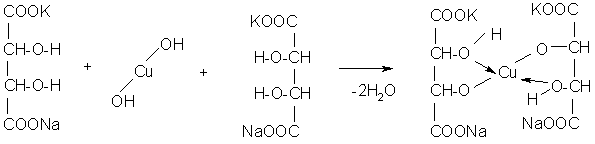
Реактивы:
Кристаллическая лимонная кислота
Концентрированная серная кислота
Известковая вода
Раствор йода в иодиде калия
Раствор гидроксида натрия
Ход работы:
Для выполнения этого опыта нужно взять три пробирки: две обыкновенные и одну с газоотводной трубкой.
В обыкновенные пробирки наливают: в одну - известковую воду, а в другую - раствор йода в иодиде калия, почти полностью обесцвеченный добавлением нескольких капель раствора щелочи.
В пробирку с изогнутой газоотводной трубкой помещают ~0,5 г кристаллической лимонной кислоты, приливают ~2 мл концентрированной серной кислоты и закрепляют пробирку в держателе. Осторожно нагревают реакционную смесь. Конец газоотводной трубки помещают в пламя другой спиртовки. Сразу начинается разложение лимонной кислоты с образованием оксида углерода (II), оксида углерода (IV) и ацетона.
Оксид углерода (II) обнаруживают по голубоватому пламени у отверстия газоотводной трубки.
Оксид углерода (IV) обнаруживают при пропускании выделяющегося газа через раствор известковой воды (по ее помутнению).
Ацетон обнаруживают, пропуская газ через раствор йода в йодиде калия (образуется осадок йодоформа, имеющий специфический запах)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.