Реактивы:
Фталевая кислота
Ход работы:
В сухую пробирку помещают ~0,1-0,2 г ортофталевой кислоты и нагревают ее на пламени спиртовки, держа пробирку горизонтально. Образуется фталевый ангидрид, который сублимируется и вновь конденсируется на холодных стенках пробирки. Пробирку охлаждают, затем осторожно нагревают осадок фталевого ангидрида, он легко плавится и стекает на дно пробирки.
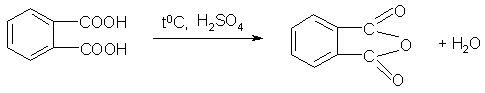
Реактивы:
Фенол
Фталевый ангидрид
Концентрированная серная кислота
Ход работы:
В сухую пробирку помещают ~0,2 г фенола, ~0,1 г фталевого ангидрида, ~5 капель концентрированной серной кислоты и осторожно нагревают на пламени спиртовки. Смесь плавится, происходит конденсация фенола с фталевым ангидридом:
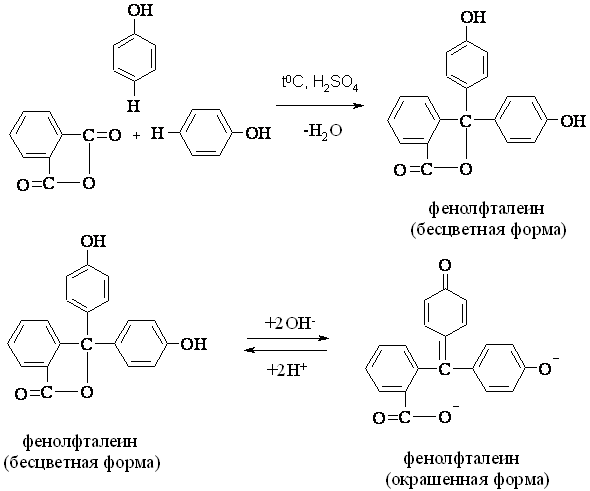
Затем, пробирку охлаждают на воздухе. К охлажденной смеси приливают полпробирки воды и энергично встряхивают. Полученный раствор переносят в другую пробирку и добавляют несколько капель раствора щелочи. В щелочной среде появляется малиново-красное окрашивание, что указывает на присутствие фенолфталеина в растворе.
В щелочной среде происходит изомеризация одного из бензольных ядер, образуется хиноидная группировка, которая и обуславливает появление окраски. При подкислении раствора окраска исчезает, при внесении щелочи она вновь появляется. Указанное свойство фенолфталеина используют в аналитической химии как показатель (индикатор) реакции среды.
Если вместо фенола взять резорцин (двухатомный фенол) и проводить опыт аналогично вышеописанному, то образуется флуоресцеин. Раствор флуоресцеина в щелочной среде имеет красивую окраску, в проходящем свете красную, в отраженном зеленую (флуоресценция).
Реактивы:
Раствор 1%-ный фенола
Раствор 1%-ный хлорида железа
Молочная кислота
Ход работы:
К ~3 мл 1%-ного раствора фенола прибавляют несколько капель 1%-ного раствора хлорида железа (III). Жидкость окрашивается в ярко-фиолетовый цвет вследствие образования комплексных фенолятов трехвалентного железа. К полученной жидкости добавляют несколько капель молочной кислоты и наблюдают изменение цвета раствора в зелено-желтый благодаря образованию лактата железа (CH3CH(OH)COO)3Fe.
Реактивы:
Молочная кислота
Концентрированная серная кислота
Ход работы:
Смесь равных объемов (по ~0.5 мл) молочной и серной кислот осторожно нагревают в пробирке с газоотводной трубкой. Выделяющийся оксид углерода (II) зажигают у отверстия газоотводной трубки, он горит голубоватым пламенем:
to C, H2SO4
CH3-CH(OH)-COOH ![]() CH3-CHO + H-COOH
CH3-CHO + H-COOH
H-COOH ® CO + H2O
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.