иодоэтилат магния
Эту реакцию используют для определения количества гидроксильных групп в молекуле спирта, которые легко установить, измерив объем предельного газообразного углеводорода, например метана (реакция Чугаева-Церевитинова).
Кислотные свойства спиртов изменяются при введении в их молекулу других атомов или групп атомов. Так, если в молекулу спирта ввести атом или группу атомов, которые имеют отрицательный индукционный эффект и вызывают смещение электронной плотности соседних связей на себя, то эти атомы или группы атомов увеличивают полярность связи О-Н, то есть повышают кислотные свойства спиртов:
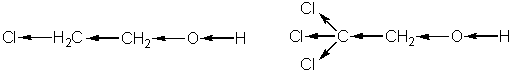
2-хлорэтанол 2,2,2-тоихлорэтанол
Поэтому, степень диссоциации 2-хлорэтанола в 10 раз больше, чем метанола, а 2,2,2-трихлорэтанола – еще в 10 раз повышается по сравнению с 2-хлорэтанолом. По этой причине спирт (F3C)3-C-О-Н становится настолько кислотным, что может вытеснять угольную кислоту из ее солей.
Введение в молекулу спирта алкильных радикалов также влияет на его кислотные свойства. Алкильные радикалы, обладая положительным индукционным эффектом (+I), увеличивают электронную плотность на атоие кислорода гидроксильной группы, что приводит к снижению устойчивости анионов R-СН2-О-. В связи с этим вероятность отщепления протона от такого спирта уменьшается, а соответственно уменьшается и способность спирта образовывать такого рода анионы. Еще слабее выражены кислотные свойства у вторичных и особенно у третичных спиртов (за счет положительного индукционного влияния трех радикалов):
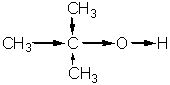
По способности отщеплять водород в виде протона спирты можно разместить в следующий ряд:
|
метиловый спирт |
> |
первичные спирты |
> |
вторичные спирты |
> |
третичные спирты |
Спирты проявляют и основные свойства. Так, они вступают во взаимодействие с сильными кислотами. При этом протон кислоты занимает свободную пару электронов атома кислорода группы –ОН и присоединяется к нему координационной связью. Такое взаимодействие приводит к образованию положительного иона алкоксония, который является анионом кислоты и дает соответствующую соль оксония:
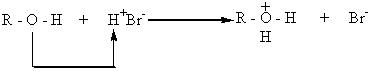
Основные свойства изменяются по сравнению с кислотными в противоположном направлении. Группы атомов, которые увеличивают электронную плотность на атоме кислорода группы –ОН, повышают скорость присоединения протона кислоты к атому кислорода этой группы и повышают таким образом основные свойства спирта. По способности присоединять протон спирты можно расположить в такой ряд:
В этом ряду основные свойства наиболее сильно выражены у третичных, наиболее слабо – у метилового спирта.
При взаимодействии спиртов с галогеноводородными кислотами или галогеноводородами, галогенидами фосфора или с тионилхлоридом гидроксильная группа в их молекуле замещается на галоген.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.