Реакционная способность спиртов к дегидратации, то есть к образованию из них этиленовых соединений, изменяется в таком порядке:
третичные спирты > вторичные спирты >первичные спирты
Некоторые третичные спирты дегидратируются настолько легко, что их можно перегнать только в случае, если предотвратить попадание в них даже лабораторного воздуха, который содержит в незначительных количествах пары кислот.
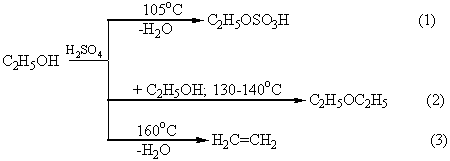
Дегидратация спиртов в присутствии концентрированной H2SO4 в зависимости от температуры, соотношения объемов спирта и кислоты может осуществляться с образованием разных продуктов. Например, этиловый спирт при 105оС образует с серной кислотой кислый сложный эфир – этилсерную кислоту (реакция 1). При избытке спирта и более высокой температуре (130 –140оС) осуществляется межмолекулярная дегидратация, главным продуктом которой является диэтиловый эфир (простой эфир; реакция 2). При температуре выше 160оС этилсерная кислота разлагается с образованием этилена (реакция 3):
А.М.Зайцев (1875 г.) установил, что при отщеплении воды от спиртов образуются наиболее алкилированные этиленовые углеводороды (правило Зайцева). Например, при дегидратации 3-метилбутанола-2 отщепление воды осуществляется за счет гидроксила и атома водорода, который находится у соседнего наименее гидрогенизованного β-углеродного атома. В результате образуется 2-метилбутен-2:
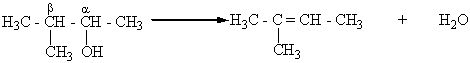
Отщепление воды от спиртов по правилу Зайцева связано с образованием в ходе реакции промежуточных наиболее устойчивых карбкатионов, которые потом превращаются в наиболее алкилированные этиленовые углеводороды, термодинамически более устойчивые, чем менее алкилированные алкены.
Спирты легко дегидратируются и в газовой фазе над нагретым оксидом алюминия или пористой глиной. Например, из этилового спирта по этому методу получают этилен с высоким выходом:
![]()
Алкилированием называют реакции введения в молекулы органических веществ алкильных радикалов. При введении алкильного радикала в молекулу спирта вместо атома водорода ОН-группы получают простые эфиры. Алкилировать спирты можно спиртами, как это осуществляется при их межмолекулярной дегидратации:
![]()
Можно алкилировать спирты галоидными алкилами. Однако спирты являются слабыми нуклеофилами и с галоидными алкилами реагируют чрезвычайно медленно. Если реакцию галоидных алкилов проводить не со спиртами, а с алкоголятами, то простые эфиры образуются быстрее, поскольку алкоголят-ионы – сильные нуклеофилы и алкилирование в этом случае осуществляется очень активно:
![]()
метилэтиловый эфир
Алкилировать алкоголяты можно и диалкилсульфатами:
![]()
Взаимодействие алкоголятов с алкилгалогенидами является общим методом получения простых эфиров, известным под названием „синтеза Вильямсона”.
Реакция алкоголятов с галогеналкилами осуществляется по SN2 – механизму:
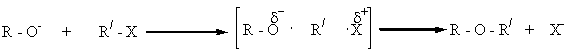
Спирты при 300-400оС и в присутствии медных и других катализаторов окисляются кислородом воздуха. Такие окислители, как KMnO4, хромовая смесь, окисляют спирты уже при комнатной температуре. В зависимости от того, какой это спирт – первичный, вторичный или третичный – при окислении образуются разные продукты.
Первичные спирты при окислении дают альдегиды с таким же количеством углеродных атомов, как и в молекуле исходного спирта. Альдегиды в этих условиях могут окисляться в карбоновые кислоты. Чтобы избежать дальнейшего окисления, альдегиды необходимо быстро выводить из реакционной смеси:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.