![]() Энергия водородных связей намного
меньше, чем энергия обычной ковалентной связи, и равняется 20,934-41,868 кДж/моль, в то время как энергия обычной связи О-Н составляет
456,36 кДж/моль. Во время кипения все водородные связи
разрушаются.
Энергия водородных связей намного
меньше, чем энергия обычной ковалентной связи, и равняется 20,934-41,868 кДж/моль, в то время как энергия обычной связи О-Н составляет
456,36 кДж/моль. Во время кипения все водородные связи
разрушаются.
![]() Молекулы спиртов полярны и имеют дипольные моменты. Например, дипольный
момент метилового спирта равняется 1,69 D.
Валентный угол,
Молекулы спиртов полярны и имеют дипольные моменты. Например, дипольный
момент метилового спирта равняется 1,69 D.
Валентный угол, ![]() образованный связями атома кислорода в молекуле спирта,
, составляет 110о25/.
образованный связями атома кислорода в молекуле спирта,
, составляет 110о25/.
![]() Спирты являются высокореакционными
соединениями благодаря присутствию в их молекуле функциональной группы ОН. В
молекулах спиртов содержатся полярные связи О – Н и С – О, которые легко
вступают в разнообразные реакции.
Спирты являются высокореакционными
соединениями благодаря присутствию в их молекуле функциональной группы ОН. В
молекулах спиртов содержатся полярные связи О – Н и С – О, которые легко
вступают в разнообразные реакции.
![]() Присутствие в молекулах спиртов гидроксильной группы обуславливает их
кислотно-основные свойства. Поскольку атом кислорода этой группы более
электроотрицателен, чем атомы углерода и водорода, то электронная плотность
смещается от этих атомов к кислороду. Связи О – Н и С – О поляризуются:
Присутствие в молекулах спиртов гидроксильной группы обуславливает их
кислотно-основные свойства. Поскольку атом кислорода этой группы более
электроотрицателен, чем атомы углерода и водорода, то электронная плотность
смещается от этих атомов к кислороду. Связи О – Н и С – О поляризуются:
![]()
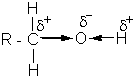
Поэтому в химических реакциях спирты могут отдавать протон и проявлять, таким образом, кислотные свойства. Кроме того, на атоме кислорода гидроксильной группы спирта есть свободные пары электронов. За счет этих электронов (в реакциях проявляет активность только одна электронная пара) спирты могут также присоединять протон к атому кислорода ОН-группы и проявлять при этом основные свойства. Таким образом, спирты. Согласно теории Бренстеда-Лоури, имеют кислотно-основные свойства.
Для спиртов существуют реакции, которые осуществляются как с участием атома водорода гидроксильной группы (кислотные свойства), так и с участием всей гидроксильной группы (основные свойства). Однако как кислотные, так и основные свойства у них выражены слабо. Поэтому растворы спиртов в воде нейтральны и не изменяют цвет индикаторов. Константа ионизации для метилового спирта приблизительно 1ּ10-17, для этилового спирта - 1ּ10-18, а для воды – 1,8ּ10-16, то есть спирты в сравнении с водой имеют более слабые кислотные свойства.
2R – OH + 2Na → 2R – ONa + H2
Название алкоголятов образуют от названия углеводородного радикала спирта, прибавляя к нему суффикс –ат и название металла. Например, метилат натрия Н3С-ОNa, этилат натрия Н3С-СН2-ОNa и т.д.
Алкоголяты – твердые вещества, легко разлагаются водой, которая является более сильной кислотой, чем спирт:
R – ONa + H2O ⇄ R – OH + NaOH
Спирты активно вступают в реакцию с магнийорганическими соединениями. При этом образуются предельные углеводороды и галогеналкоголяты магния :
H3C – CH2 – OH + H3C – MgI → CH4 + H3C – CH2 – O – MgI
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.