Существуют и трехатомные фенолы, как, например, порогаллол, флоро-глюцин и гидроксигидрохинон:
|
|
|
|
Пирогаллол(1,2,3-тригидроксибензол) рядовой изомер |
Флороглюцин(1,3,5-тригидроксибензол) симметричный изомер |
Гидроксигидрохинон(1,2,4-тригидроксибензол) несимметричный изомер |
1. Сплавление натриевых солей ароматических сульфокислот со щелочами:
![]()
Na – соль бензосульфокислоты
|
|
3. “Кумольный” способ (из бензола и пропилена):
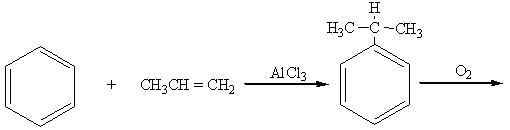
бензол пропилен изопропилбензол (кумол)
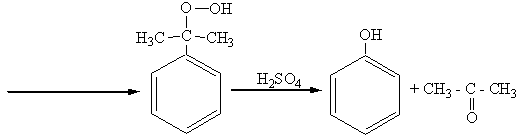
гидроперекись изопропилбензола фенол ацетон
4. Из солей диазония, например: из хлористого фенилдиазония:
Важнейшим свойством фенолов, отличающих их от спиртов, является их кислотность. Кислотные свойства фенолов обусловлены той относительной легкостью, с которой фенол теряет протон:
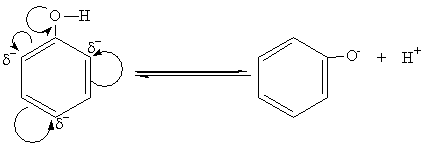
феноксид-ион
В фенольном гидроксиле свободная пара электронов атома кислорода взаимодействует с π-электронами бензольного кольца, сдвигаясь в сторону кольца. Атом кислорода,поскольку его отрицательный заряд уменьшается, а положительный несколько увеличивается, сильнее притягивает к себе электронную пару атома водорода гидроксильной группы. Это облегчает отщепление водорода в виде протона, то есть процесс диссоциации. Однако кислотные свойства фенола все же слабее, что следует из сравнения констант диссоциации Kд фенола и самой слабой минеральной кислоты-угольной (H2CO3): KдH2CO3 =4,9·10-7; KдС6Н5ОН = 1,3∙10-10.
Из сопоставления данных констант видно, что KдС6Н5ОН примерно в 3300 раз меньше, чем KдH2CO3. Тем не менее, кислотные свойства ощутимо сильнее, чем у алифатических спиртов, так как последние не реагируют с NaOH, а фенолы с этим веществом взаимодействуют.
Поскольку фенолы имеют ароматическое ядро и одну или несколько ОН-групп, для них характерны два основных типа реакций;
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.