Для решения практических задач используют диаграммы состояния многокомпонентных систем. Они позволяют представить связь между параметрами состояния и электрофизическими свойствами системы.
Получить нужное свойство сплава или раствора можно изменив его состав или структуру. Данные необходимые для такого подбора приводятся в справочниках.
Для разработки технологического синтеза полупроводниковых соединений и сплавов, для легирования их различными примесями, для выращивания монокристаллов и эпитаксиальных слоев необходимо знание диаграмм равновесия однокомпонентных или многокомпонентных систем содержащих полупроводниковые фазы.
По характеру диаграммы равновесия бинарных или многокомпонентных систем делятся на различные типы, причем многообразие их тем больше, чем больше число компонентов входящих в их состав. Основное влияние на структуру диаграммы равновесия оказывает склонность компонентов к взаимодействию в твердом, жидком и газообразном состоянии, т.е. их взаимная растворимость (полная или частичная), образование химических соединений (промежуточных фаз). Реальные диаграммы состояния строятся на основе ряда экспериментальных исследований (термический анализ, фазовый анализ). Однако основные типы диаграмм и их элементы могут быть выведены из теории термодинамических потенциалов и на основе знаний термодинамических свойств.
Существует несколько видов простейших диаграмм равновесия бинарных систем. Они различаются между собой характером взаимодействия компонентов А и В в твердом состоянии.
а) системы, компоненты которых образуют растворы (полная растворимость), твердые растворы – смешанные кристаллы.
Состав фаз определяется по правилу рычага: Точка, отвечающая составу гетерогенной двойной системы, располагается на прямой, соединяющей точки, представляющие сосуществующие фазы. При этом отрезки, отсекаемые на прямой этой точкой, обратно пропорциональны количествам каждой из фаз.
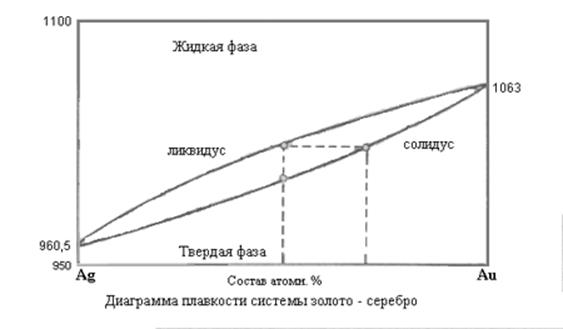
б) системы с полной растворимостью:
с точкой максимума и с точкой минимума.
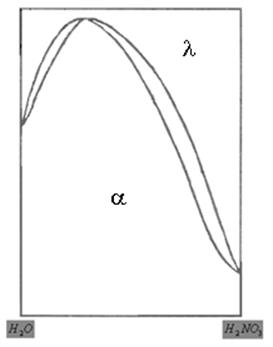
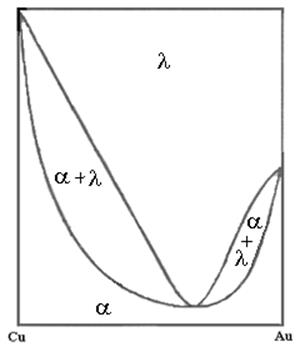
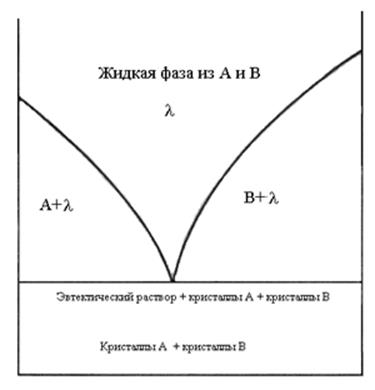
в) диаграмма типа эвтектика – полная растворимость в жидком состоянии и полная нерастворимость в твердом.
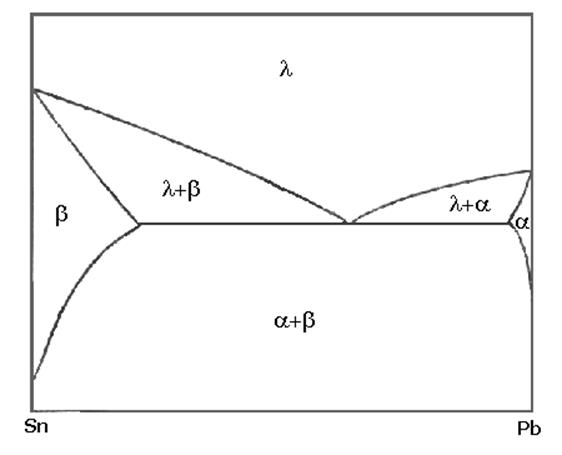
д) эвтектика из твердых растворов a и b. Полная растворимость в жидком состоянии, и ограниченная растворимость в твердом.
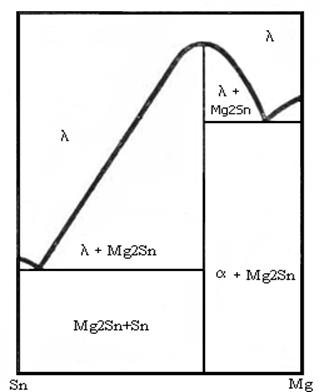 Путем различных
сочетаний основных элементов диаграмм можно получить все многообразие диаграмм
равновесия, которое встречается в реальных бинарных системах.
Путем различных
сочетаний основных элементов диаграмм можно получить все многообразие диаграмм
равновесия, которое встречается в реальных бинарных системах.
Если пик дистектики имеет острую форму, то вещества образуют устойчивое химическое соединение, если - тупую, то химическое соединение неустойчивое.
Первый закон термодинамики справедлив для обычных систем, состоящих из большого числа частиц, и для систем состоящих из небольшого числа частиц, и для отдельных частиц. Второй же закон носит статистический характер и относится исключительно к системам, состоящим из очень большого числа частиц, так как только к таким системам строго применимы законы статистики. Если же рассматривать системы из не очень большого числа частиц, то выводы из второго закона не могут быть строго применимы к ним. К системам, состоящим из малого числа частиц, второй закон не относится.
Как хорошо видно на примере газов такие понятия, как температура и давление, играющие основную роль в термодинамике, обладают по существу статистической природой, т.е. являются выражением некоторых свойств вещества, обусловленных совместным действием очень большого числа частиц.
Температура определяется средней кинетической энергией поступательного движения частиц, хотя кинетическая энергия отдельных частиц может значительно отличаться от этой величины. Точно также давление газа выражает суммарный эффект ударов молекул о стенку сосуда и является величиной средней для большого количества молекул, отдельные из которых обладают в момент удара самыми различными количествами движения и ударяются о стенку под самыми разными углами.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.